
Wetenschap
Wat gebeurt er als ferrosulfaatkristallen worden verwarmd?
1. Eerste uitdroging: Terwijl ijzersulfaatkristallen worden verwarmd, ondergaan ze eerst uitdroging. In het kristalrooster aanwezige watermoleculen worden verdreven, waardoor watervrij ijzersulfaat (FeSO4) ontstaat.
FeSO4·7H2O (ijzersulfaat-heptahydraat) → FeSO4 (watervrij ijzersulfaat) + 7H2O (waterdamp)
2. Ontbinding: Bij verdere verwarming begint watervrij ijzersulfaat te ontleden. Deze ontleding vindt plaats in verschillende fasen, waarbij in elke fase verschillende gassen vrijkomen en verschillende ijzeroxiden worden geproduceerd:
a) Fase 1: In de eerste fase valt ijzersulfaat uiteen in ijzeroxide (Fe2O3), zwaveldioxide (SO2) en zwaveltrioxide (SO3).
2FeSO4 → Fe2O3 + SO2 + SO3
b) Fase 2: Naarmate de verwarming voortduurt, reageert het resterende ijzeroxide verder met zwaveldioxide om ijzeroxide (FeO) en meer zwaveltrioxide te vormen.
Fe2O3 + 2SO2 → 2FeO + SO3
3. Eindproducten: De eindproducten die worden verkregen door de volledige ontleding van ferrosulfaatkristallen zijn:
- IJzeroxide (Fe2O3):een roodbruine vaste stof
- IJzeroxide (FeO):een zwarte vaste stof
- Zwaveldioxide (SO2):een kleurloos gas met een scherpe geur
- Zwaveltrioxide (SO3):een kleurloos gas dat met water reageert en zwavelzuur (H2SO4) vormt
Deze ontledingsproducten zijn afhankelijk van de specifieke temperatuur en omstandigheden van het verwarmingsproces. In praktische toepassingen wordt de thermische ontleding van ferrosulfaat vaak uitgevoerd als methode voor de productie van ijzeroxiden en zwavelverbindingen.
 Een grensdans van amyloïde-β stapt in dementie
Een grensdans van amyloïde-β stapt in dementie Welke verbinding bestaat uit covalente bindingen?
Welke verbinding bestaat uit covalente bindingen?  De computationele methoden van onderzoekers maken de weg vrij voor de volgende generatie membraantechnologie voor waterzuivering
De computationele methoden van onderzoekers maken de weg vrij voor de volgende generatie membraantechnologie voor waterzuivering Wetenschappers creëren een liefdesmolecuul met minder complicaties
Wetenschappers creëren een liefdesmolecuul met minder complicaties Multidisciplinaire samenwerking leidt tot katalysatoren die tot 50 keer effectiever zijn
Multidisciplinaire samenwerking leidt tot katalysatoren die tot 50 keer effectiever zijn
 Lidar-onderzoek suggereert dat de verliezen aan koolstofopslag groter zijn dan gedacht in Amazone als gevolg van verliezen aan de rand van bossen
Lidar-onderzoek suggereert dat de verliezen aan koolstofopslag groter zijn dan gedacht in Amazone als gevolg van verliezen aan de rand van bossen Nieuwe studie voorspelt uittocht van mensen in Bangladesh als gevolg van zeespiegelstijging
Nieuwe studie voorspelt uittocht van mensen in Bangladesh als gevolg van zeespiegelstijging Onderzoekers delen hun perspectief op de belangrijkste elementen van het herstel van de ozonlaag
Onderzoekers delen hun perspectief op de belangrijkste elementen van het herstel van de ozonlaag NASA ziet vorming van tropische storm Fernanda in de oostelijke Stille Oceaan
NASA ziet vorming van tropische storm Fernanda in de oostelijke Stille Oceaan Nepal getroffen door ergste bosbranden in bijna tien jaar
Nepal getroffen door ergste bosbranden in bijna tien jaar
Hoofdlijnen
- Onderzoek onthult dat controversiële insecticiden giftig zijn voor zangvogels
- Onderzoekers bepalen hoe muggen een dengue-virusinfectie overleven
- Uit het laatste onderzoek blijkt dat eksterganzen de verleiding van NT-mangogekte weerstaan
- Antibioticavervuiling verstoort het darmmicrobioom en blokkeert het geheugen van waterslakken, zo blijkt uit onderzoek
- Wat octopus en menselijke hersenen gemeen hebben
- Welk organel voert de vertaling in DNA uit?
- Hoe hotspots van genetische variatie zich ontwikkelden in menselijk DNA
- De 'stille code' van eiwitten beïnvloedt de manier waarop cellen bewegen
- Nieuw deep learning-model gebruikt video om de embryonale ontwikkeling te meten
- Vogelveren inspireren onderzoekers om levendige nieuwe kleuren te produceren

- Onderzoekers beschrijven het volledige scala aan ceramiden dat wordt aangetroffen in de bovenste laag van de menselijke huid
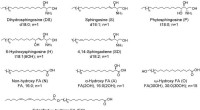
- Darmbacteriën vormen de sleutel tot het maken van universeel bloed
- Het proteoom van de zoete aardappel opgraven
- Oud brood wordt nieuw textiel

 Waarom hebben de Russen het diepste gat ter wereld afgesloten?
Waarom hebben de Russen het diepste gat ter wereld afgesloten?  Astronomen onderzoeken de atmosfeer van een nabijgelegen koude bruine dwerg
Astronomen onderzoeken de atmosfeer van een nabijgelegen koude bruine dwerg  Nieuw geometrisch model verbetert voorspellingen van vloeistofstroom in gesteente
Nieuw geometrisch model verbetert voorspellingen van vloeistofstroom in gesteente Nieuwe chip opent de deur naar AI-computing met lichtsnelheid
Nieuwe chip opent de deur naar AI-computing met lichtsnelheid  Terug naar de tekentafel:offshore windturbines opnieuw uitvinden
Terug naar de tekentafel:offshore windturbines opnieuw uitvinden Ingenieurs onderzoeken milieuproblemen van nanotechnologie
Ingenieurs onderzoeken milieuproblemen van nanotechnologie geschud, niet geroerd:ultrasnelle herschikking van skyrmion
geschud, niet geroerd:ultrasnelle herschikking van skyrmion Het was een turbulente start, maar Juno levert nu spectaculaire inzichten in Jupiter
Het was een turbulente start, maar Juno levert nu spectaculaire inzichten in Jupiter
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

