
Wetenschap
Een grensdans van amyloïde-β stapt in dementie
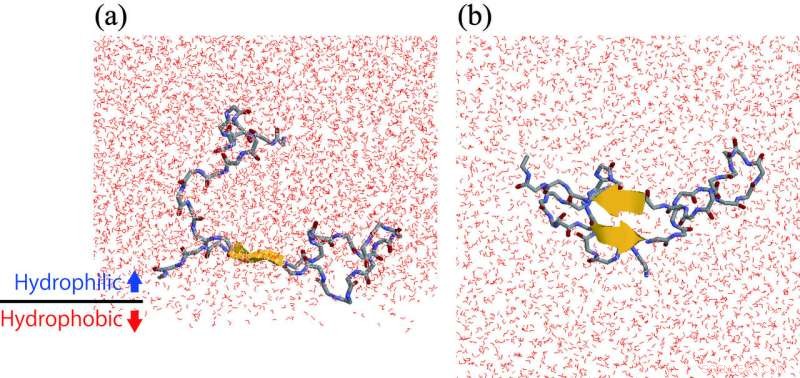
(a) Een Aβ-peptide dat een β-haarspeldstructuur vormt op het hydrofiele/hydrofobe grensvlak. (b) Uitzicht vanaf de onderkant van paneel (a). Krediet:ExCELLS/IMS
De ziekte van Alzheimer wordt veroorzaakt door aggregaten van amyloïde-β (Aβ)-peptiden. Deze aggregatie wordt versneld aan het celmembraanoppervlak. Met behulp van moleculaire dynamica-simulaties en NMR-experimenten, de onderzoeksgroep van ExCELLS heeft de reden voor dit fenomeen onthuld. De bevindingen werden gepubliceerd in de Journal of Physical Chemistry B .
Veel eiwitten aggregeren in hogere concentraties en vormen bolvormige stoffen die oligomeren worden genoemd en naaldvormige stoffen die amyloïde fibrillen worden genoemd. Deze eiwitaggregaten veroorzaken meer dan 30 soorten ziekten. Bijvoorbeeld, Men denkt dat de ziekte van Alzheimer wordt veroorzaakt door de oligomeren en amyloïde fibrillen die worden gevormd door aggregatie van amyloïde-β (Aβ)-peptiden. Het is bekend dat aggregatie van Aβ-peptide wordt versneld op een hydrofiel/hydrofoob grensvlak zoals een celmembraanoppervlak. Echter, waarom de Aβ-peptiden de neiging hebben om op het oppervlak te aggregeren, is nog niet goed begrepen.
De onderzoeksgroep van Exploratory Research Centre on Life and Living Systems en Institute for Molecular Science, Japan, werkte aan dit probleem met behulp van moleculaire dynamische simulaties en nucleaire magnetische resonantie spectroscopie-experimenten. Ze ontdekten dat de Aβ-peptiden de neiging hebben zich te verzamelen op het hydrofiele/hydrofobe grensvlak. Dat is, de lokale concentratie van Aβ op het grensvlak is hoger dan die in bulkwateroplossing. In aanvulling, β-haarspeldstructuren worden meer gevormd aan het grensvlak dan in de bulkwateroplossing. In de β-haarspeldstructuur, zoals weergegeven in de afbeelding, een deel van het Aβ-peptide strekt zich recht uit en vormt intramoleculaire waterstofbruggen. Daarom, een ander Aβ-peptide dat dicht bij dit peptide komt, maakt gemakkelijk intermoleculaire waterstofbruggen en heeft de neiging te aggregeren. Op deze manier, de onderzoeksgroep verduidelijkte dat aggregatieversnelling van de Aβ-peptiden op het celmembraanoppervlak te wijten is aan de hoge concentratie van Aβ-peptiden op het celmembraanoppervlak, en hun structuur, waardoor ze aan elkaar binden.
Deze ontdekking verheldert het mechanisme waarmee het Aβ-peptide aggregeert op het membraanoppervlak van zenuwcellen. Dit mechanisme zou in de toekomst kunnen worden toegepast op het ontwikkelen van remmers tegen de veroorzakers van de ziekte van Alzheimer.
 Biochemici ontdekken mechanisme dat griepvirussen helpt evolueren
Biochemici ontdekken mechanisme dat griepvirussen helpt evolueren Onderzoek beschrijft hoe ionen een sleutelrol spelen bij het beheersen van slijmvliesoppervlakken
Onderzoek beschrijft hoe ionen een sleutelrol spelen bij het beheersen van slijmvliesoppervlakken Methode voor het volgen van reacties tussen lucht en op koolstof gebaseerde verbindingen vastgesteld
Methode voor het volgen van reacties tussen lucht en op koolstof gebaseerde verbindingen vastgesteld Wat is een Ionische verbinding?
Wat is een Ionische verbinding?  Een ballon laten zweven zonder Helium
Een ballon laten zweven zonder Helium
 Voors en tegens van Algae Biodiesel
Voors en tegens van Algae Biodiesel  NASA krijgt een laatste blik op overblijfselen Tropische Depressie Beatriz in de Golf
NASA krijgt een laatste blik op overblijfselen Tropische Depressie Beatriz in de Golf Kunnen nanodeeltjes de brandstofproductie veranderen?
Kunnen nanodeeltjes de brandstofproductie veranderen?  Vroege levensstadia van eekhoorns
Vroege levensstadia van eekhoorns Waar de wind waait:nieuwe studie toont krachtige krachten die het landschap van Argentinië vormgeven
Waar de wind waait:nieuwe studie toont krachtige krachten die het landschap van Argentinië vormgeven
Hoofdlijnen
- Wat doet ethanol in een DNA-extractie?
- Vliegtuigbrandstof uit suikerriet een realistisch vooruitzicht
- Hoe een DNA-model te labelen
- Zenuwonderzoek laat zien hoe cellen zich aanpassen om schade te helpen herstellen
- Hoe een model te maken Plant & Dierlijke cel
- Cellulaire ademhaling bij de mens
- De Stoned Ape-hypothese:hebben paddo's de menselijke evolutie beïnvloed?
- Science Fair-projecten met nagellak
- De voordelen van over jezelf praten in de derde persoon
- Koud sinteren produceert condensatormateriaal bij record lage temperaturen

- Virtuele bibliotheek van 1 miljoen nieuwe macrolide-steigers kan de ontdekking van geneesmiddelen helpen versnellen

- Nobelprijswinnende techniek zoals Google Earth voor moleculen

- Een manier om de absolute stereochemie van kleine, organische moleculen
- Met röntgentomografie kunnen onderzoekers solid-state batterijen zien opladen, afvoer

 Onderzoeker bestudeert effecten microplastics op oceaan
Onderzoeker bestudeert effecten microplastics op oceaan Hoe bevriest water?
Hoe bevriest water?  Klimaatverandering vernietigt een barrière die de Amerikaanse oostkust beschermt tegen orkanen
Klimaatverandering vernietigt een barrière die de Amerikaanse oostkust beschermt tegen orkanen Afbeelding:komeet 67P/Churyumov-Gerasimenko horizon
Afbeelding:komeet 67P/Churyumov-Gerasimenko horizon Honger is niet een gebrek aan voedsel, maar eerder eenzaamheid in Mentawai
Honger is niet een gebrek aan voedsel, maar eerder eenzaamheid in Mentawai Biologische experimenten op de gisting van gist
Biologische experimenten op de gisting van gist  Een plotselinge overstroming zet Zuid-Franse dorpen onder water, velden
Een plotselinge overstroming zet Zuid-Franse dorpen onder water, velden Bevedering van het plasma-nest:kleine structuren helpen kortsluiting in plasma-apparaten te voorkomen
Bevedering van het plasma-nest:kleine structuren helpen kortsluiting in plasma-apparaten te voorkomen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

