
Wetenschap
Een munt van 6,80 g wordt opgelost in salpeterzuur en 6,21 g AgCl wordt neergeslagen door de toevoeging van een overmaat natriumchloride. Bereken het percentage zilveren munt?
1. Bereken het aantal mol AgCl dat is neergeslagen:
Mol AgCl =massa AgCl / molaire massa AgCl
Mol AgCl =6,21 g / 143,32 g/mol
Mol AgCl =0,0433 mol
2. Omdat AgCl wordt gevormd door de reactie van zilver- (Ag) en chloride-ionen (Cl), zijn de aantallen molen AgCl gelijk aan de molen Ag die in de munt aanwezig zijn. Daarom zijn de mol Ag in de munt 0,0433 mol.
3. Bereken de massa van Ag in de munt:
Massa van Ag =mol Ag * molaire massa van Ag
Massa Ag =0,0433 mol * 107,87 g/mol
Massa Ag =4,66 g
4. Bereken het percentage zilver in de munt:
Percentage zilver =(massa van Ag / totale massa van de munt) * 100
Percentage zilver =(4,66 g / 6,80 g) * 100
Percentage zilver ≈ 68,53%
Daarom bevat de munt ongeveer 68,53% zilver.
 Efficiënte vermindering van kooldioxide onder zichtbaar licht met een nieuwe, goedkope katalysator
Efficiënte vermindering van kooldioxide onder zichtbaar licht met een nieuwe, goedkope katalysator Wat is het oxidatiegetal van nitrosylfluoride?
Wat is het oxidatiegetal van nitrosylfluoride?  Nieuw, gevoeliger sensor voor het evalueren van de veiligheid van geneesmiddelen
Nieuw, gevoeliger sensor voor het evalueren van de veiligheid van geneesmiddelen Gemodificeerde peptiden kunnen de groei en ontwikkeling van planten stimuleren
Gemodificeerde peptiden kunnen de groei en ontwikkeling van planten stimuleren Succes in het synthetiseren van biologisch afbreekbare plastic materialen met behulp van zonlicht en CO2
Succes in het synthetiseren van biologisch afbreekbare plastic materialen met behulp van zonlicht en CO2
 Energie-efficiëntie mogelijk maken in stadsplanning
Energie-efficiëntie mogelijk maken in stadsplanning Wetenschappers heroverwegen co-evolutie van het leven in zee, zuurstofrijke oceanen
Wetenschappers heroverwegen co-evolutie van het leven in zee, zuurstofrijke oceanen Freud en Oedipus:doet een van beide er nog toe?
Freud en Oedipus:doet een van beide er nog toe?  Ambrosia-pollen onder controle houden in Detroit:een no-mow-oplossing voor Motown?
Ambrosia-pollen onder controle houden in Detroit:een no-mow-oplossing voor Motown?  Miereninvasie:hoe huisdieren ongedierte worden
Miereninvasie:hoe huisdieren ongedierte worden
Hoofdlijnen
- Zoogdiercellen observeren met supersnelle zachte röntgenstralen
- Hoe stamcellen werken
- Ouders vertonen vooringenomenheid in rivaliteit tussen broers en zussen, zegt onderzoek
- Wetenschappers tonen aan dat eiwitten die cruciaal zijn in dag-nachtcycli cellen ook beschermen tegen mutaties
- Hoe bacteriën zichzelf vaccineren tegen virale indringers
- Nieuwe structuren bieden inzicht in hoe een bacteriële motor bacteriële chemotaxis aandrijft, een belangrijk infectieus proces
- Hoe kunnen nieuwe cellen iemands gezichtsvermogen herstellen?
- Wat is het mechanisme voor de meeste evolutionaire veranderingen?
- Hoe weet je lichaam het verschil tussen dominante en recessieve genen?
- Parfummakers zoeken natuurlijke, duurzame geuren

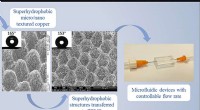
- Nieuw productieproces creëert superkleine kanalen om water af te weren en medische, elektronische apparaten
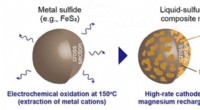
- Hoogwaardige oplaadbare magnesiumbatterijen komen een stap dichter bij realisatie
- Orale medicijnen ontwikkelen die efficiënter werken

- Nieuwe symmetriedoorbrekende methode opent weg voor bioactieve stoffen

 Studie observeert het naast elkaar bestaan van topologische randtoestanden en supergeleiding in staneenfilms
Studie observeert het naast elkaar bestaan van topologische randtoestanden en supergeleiding in staneenfilms Kunnen schimmels de grassen van Texas helpen omgaan met de klimaatverandering?
Kunnen schimmels de grassen van Texas helpen omgaan met de klimaatverandering?  Wat maakt ons menselijk? Studies van chimpansees en menselijk DNA kunnen dit uitwijzen
Wat maakt ons menselijk? Studies van chimpansees en menselijk DNA kunnen dit uitwijzen  Hoe reageren de ziekenhuizen in Mexico-stad als er een aardbeving plaatsvindt?
Hoe reageren de ziekenhuizen in Mexico-stad als er een aardbeving plaatsvindt?  Wetenschappers ontsluiten het geheim van wat planten doet bloeien
Wetenschappers ontsluiten het geheim van wat planten doet bloeien  Website legt uit hoe klimaatverandering New York City beïnvloedt
Website legt uit hoe klimaatverandering New York City beïnvloedt  Onderzoekers maken patronen van koolstofnanobuisjes die moirés worden genoemd voor materiaalonderzoek
Onderzoekers maken patronen van koolstofnanobuisjes die moirés worden genoemd voor materiaalonderzoek Biodiversiteit lijdt als het klimaat warmer wordt
Biodiversiteit lijdt als het klimaat warmer wordt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

