
Wetenschap
Is een neutrale oplossing een sterke elektrolyt?
Sterke elektrolyten zijn stoffen die volledig dissociëren in ionen wanneer ze in water worden opgelost. Dit betekent dat alle moleculen van de verbinding uiteenvallen in hun samenstellende ionen, wat resulteert in een hoge concentratie ionen in de oplossing. Sterke elektrolyten omvatten doorgaans ionische verbindingen zoals natriumchloride (NaCl), kaliumhydroxide (KOH) en zwavelzuur (H2SO4).
Aan de andere kant is een neutrale oplossing een oplossing waarin de concentratie waterstofionen (H+) en hydroxide-ionen (OH-) gelijk is, wat resulteert in een pH-waarde van 7. Neutrale oplossingen kunnen worden gevormd door bepaalde soorten verbindingen op te lossen, zoals water zelf, of door een zuur en een base in de juiste verhoudingen te mengen.
Hoewel sommige sterke elektrolyten neutrale oplossingen kunnen produceren wanneer ze in water worden opgelost (zoals natriumchloride, dat een neutrale oplossing vormt met een pH van 7), worden niet alle neutrale oplossingen gevormd uit sterke elektrolyten. Zuiver water is bijvoorbeeld een neutrale oplossing, maar bevat geen sterke elektrolyten. In plaats daarvan is de neutrale pH van water het gevolg van het evenwicht tussen de dissociatie van watermoleculen in H+ en OH-ionen en de recombinatie van deze ionen terug in watermoleculen.
Daarom duidt de aanwezigheid van een neutrale oplossing niet noodzakelijkerwijs op de aanwezigheid van een sterke elektrolyt. De identiteit en concentratie van de opgeloste stof bepalen de elektrolytsterkte en de pH-waarde van de oplossing.
 Waarom kunnen ionische stoffen elektriciteit geleiden als ze gesmolten zijn?
Waarom kunnen ionische stoffen elektriciteit geleiden als ze gesmolten zijn?  Nieuwe doorbraak in de strijd tegen antibioticaresistentie
Nieuwe doorbraak in de strijd tegen antibioticaresistentie Waarom wordt germanium niet gebruikt als LED-materiaal?
Waarom wordt germanium niet gebruikt als LED-materiaal?  Welke metalen is het meest stabiele goud zink zilver kalium?
Welke metalen is het meest stabiele goud zink zilver kalium?  Bio-geïnspireerde op MXene gebaseerde actuatoren voor programmeerbare slimme apparaten
Bio-geïnspireerde op MXene gebaseerde actuatoren voor programmeerbare slimme apparaten
 Satellietgegevensrecord toont impact van klimaatverandering op branden
Satellietgegevensrecord toont impact van klimaatverandering op branden Met een daling van LA's vervuiling door aerosolen, vegetatie komt naar voren als belangrijke bron
Met een daling van LA's vervuiling door aerosolen, vegetatie komt naar voren als belangrijke bron Ambtenaren in Zuid-Californië verklaren watervoorzieningswaarschuwing
Ambtenaren in Zuid-Californië verklaren watervoorzieningswaarschuwing Het bepalen van de timing van de evolutie van methanogeen
Het bepalen van de timing van de evolutie van methanogeen Wat eet de harp zeehonden?
Wat eet de harp zeehonden?
Hoofdlijnen
- Hoe planten genetische herinneringen doorgeven
- Hoe het verzamelen van nuttige genen ervoor zorgt dat oudere gisten het beter doen in moeilijkere tijden
- Fossielen van zaagvissen suggereren dat tanden waarschijnlijk zijn geëvolueerd uit schubben in oude vissen
- Belangrijke verbeteringen onthuld op Closer to Van Eyck webapplicatie
- Onderzoekers vinden dat er minstens 14, 003 plantensoorten in het Amazonebekken
- Hoe worden obligaties gedefinieerd?
- Nieuw idee over hoe de zebra zijn strepen kreeg
- Afrikaanse slaapziekte:hoe de ziekteverwekker tseetseevliegen koloniseert
- De chemische samenstelling van groene planten
In veel opzichten verschillen planten niet erg van mensen. Als je een plant en een persoon in hun basiselementen zou afbreken, zou je merken dat beide meer koolstof, waterstof en zuurstof bevatten dan w
- Bomen en planten kunnen nieuwe toevoegingen worden in lichte voedingsproducten

- Biochemici koppelen polyfenolen in perzikbladeren aan de antioxiderende werking van hun extract
- Het opruimen van Tsjernobyl kan worden geholpen door een nieuwe benadering voor röntgenanalyse

- Computationeel onderzoek beschrijft het activeringsmechanisme van p38-alpha

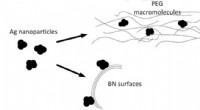
- Boornitride en zilveren nanodeeltjes om de uitstoot van koolmonoxide te verminderen
 Als de pH van een oplossing daalt tot onder 7,0 1. neemt de zuurgraad toe 2. 3. hydroniumion of waterstofconcentratie 4. hydron?
Als de pH van een oplossing daalt tot onder 7,0 1. neemt de zuurgraad toe 2. 3. hydroniumion of waterstofconcentratie 4. hydron?  NASA gaat Dellingr lanceren; CubeSat is speciaal ontworpen om de betrouwbaarheid van kleine satellieten te verbeteren
NASA gaat Dellingr lanceren; CubeSat is speciaal ontworpen om de betrouwbaarheid van kleine satellieten te verbeteren Waarom voegen waterbedrijven chloor toe aan water?
Waarom voegen waterbedrijven chloor toe aan water?  Trucs van het vak - hoe gelikte websites en apps lenen gemakkelijk maken
Trucs van het vak - hoe gelikte websites en apps lenen gemakkelijk maken Oligomere materialen om de watersplitsing te verbeteren
Oligomere materialen om de watersplitsing te verbeteren Een totale zonsverduistering zal in april voor miljoenen Amerikanen zichtbaar zijn:hier ziet u hoe u deze kunt bekijken
Een totale zonsverduistering zal in april voor miljoenen Amerikanen zichtbaar zijn:hier ziet u hoe u deze kunt bekijken  Nieuwe behandeling voor hersentumoren maakt gebruik van elektrospun vezels
Nieuwe behandeling voor hersentumoren maakt gebruik van elektrospun vezels Fermentatierevolutie? Afval wordt een schat omdat bioafval waardevolle aceton en isopropanol oplevert
Fermentatierevolutie? Afval wordt een schat omdat bioafval waardevolle aceton en isopropanol oplevert
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

