
Wetenschap
Wat is het verschil tussen koolstof 12 en 14?
Koolstof-12 is de meest voorkomende isotoop van koolstof en vormt 98,89% van alle koolstofatomen in de atmosfeer van de aarde. Het is de stabiele vorm van koolstof en vervalt niet.
Koolstof-14 is een radioactieve isotoop van koolstof, wat betekent dat het na verloop van tijd vervalt. Het heeft een halfwaardetijd van 5.730 jaar, wat betekent dat het 5.730 jaar duurt voordat de helft van de koolstof-14-atomen in een monster is vervallen. Koolstof-14 wordt in de hogere atmosfeer geproduceerd door de interactie van kosmische straling met stikstofatomen.
Het verschil in het aantal neutronen tussen koolstof-12 en koolstof-14 beïnvloedt de massa van de isotopen. Koolstof-14 is zwaarder dan koolstof-12 en dit verschil in massa kan worden gedetecteerd met behulp van een massaspectrometer.
Koolstof-14 wordt gebruikt in verschillende toepassingen, waaronder:
* Radiokoolstofdatering:Koolstof-14-datering is een techniek die wordt gebruikt om de ouderdom van organische materialen te bepalen door de hoeveelheid koolstof-14 die ze bevatten te meten. Hoe ouder het materiaal, hoe minder koolstof-14 het zal bevatten.
* Koolstof-14-labeling:Koolstof-14 kan worden gebruikt om moleculen te labelen, zodat ze kunnen worden gevolgd in biologische systemen. Deze techniek wordt vaak gebruikt in medisch onderzoek en de ontwikkeling van geneesmiddelen.
Koolstof-12 en koolstof-14 zijn beide belangrijke isotopen van koolstof met een verscheidenheid aan toepassingen. Koolstof-12 is de stabiele vorm van koolstof en de meest voorkomende isotoop, terwijl koolstof-14 een radioactieve isotoop is die in een verscheidenheid aan toepassingen wordt gebruikt, waaronder radiokoolstofdatering en koolstof-14-labeling.
 Nieuwe tool kan schadelijke blauwgroene algen identificeren
Nieuwe tool kan schadelijke blauwgroene algen identificeren Video:Waarom natte honden stinken (en andere chemie van honden)
Video:Waarom natte honden stinken (en andere chemie van honden)  Nieuwe methode maakt efficiënte monstervoorbereiding voor eencellige proteomics mogelijk
Nieuwe methode maakt efficiënte monstervoorbereiding voor eencellige proteomics mogelijk Chemici ontwikkelen hulpmiddelen die de diagnostiek van kanker kunnen helpen verbeteren, therapieën
Chemici ontwikkelen hulpmiddelen die de diagnostiek van kanker kunnen helpen verbeteren, therapieën Sub-nanodeeltjeskatalysatoren gemaakt van muntelementen als effectieve katalysatoren
Sub-nanodeeltjeskatalysatoren gemaakt van muntelementen als effectieve katalysatoren
Hoofdlijnen
- Wetenschappers ontdekken een eeuwenoud geval van identiteitsverwisseling in de Chesapeake Bay
- Onderzoekers ontdekken hoe cellen bewegen terwijl ze adhesie vermijden
- De verschillen tussen fotosynthese en ademhaling
- Nieuwe techniek maakt succesvolle kweek van stamcellen op het oppervlak van ionische vloeistoffen mogelijk
- Dit is waarom de zwerm zo snel is:de individuen anticiperen op wat de anderen zullen doen
- Hoe de afgelopen 12.000 jaar vorm hebben gegeven aan wat de mens vandaag de dag is
- Wat is het verschil tussen een gedupliceerd chromosoom en een chromaat?
- Babymanta's:nieuw licht op hun leven in Indonesische waterspeeltuin
- Wat zit er in een naam? In sommige gevallen een langere levensduur
- Wetenschappers kijken naar vogelveren om kleuren af te drukken

- Minder is meer als het gaat om het voorspellen van de geleidbaarheid van moleculen

- Een Tootsie Roll-sensor likken om de gezondheid te controleren

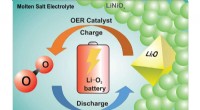
- Chemici maken doorbraak op weg naar het maken van een oplaadbare lithium-zuurstofbatterij
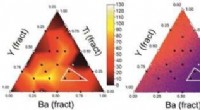
- Nieuwe aanknopingspunten voor functionele materialen ontdekken op basis van kunstmatige intelligentie
 Plastics, ziekteverwekkers en babyvoeding:wat zit er in uw schelpdieren?
Plastics, ziekteverwekkers en babyvoeding:wat zit er in uw schelpdieren?  Onderzoek laat zien hoe planten de ‘herinnering’ aan een hoog kooldioxidegehalte doorgeven aan hun nakomelingen
Onderzoek laat zien hoe planten de ‘herinnering’ aan een hoog kooldioxidegehalte doorgeven aan hun nakomelingen  Nog een paar weken observaties zouden ons kunnen vertellen of de Wow! signaal herhaalt
Nog een paar weken observaties zouden ons kunnen vertellen of de Wow! signaal herhaalt Onderzoekers onderzoeken machine learning om het sorteren van microcapsules in realtime te automatiseren
Onderzoekers onderzoeken machine learning om het sorteren van microcapsules in realtime te automatiseren Experts alarmeren over bedreiging door klimaatverandering voor cultureel erfgoed
Experts alarmeren over bedreiging door klimaatverandering voor cultureel erfgoed De universele waarheid over plakkerige oppervlakken
De universele waarheid over plakkerige oppervlakken Nu weten we hoe een zonnestorm een vloot Starlinks heeft uitgeschakeld
Nu weten we hoe een zonnestorm een vloot Starlinks heeft uitgeschakeld  Bevindingen van NASA's Juno updaten Jupiter watermysterie
Bevindingen van NASA's Juno updaten Jupiter watermysterie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

