
Wetenschap
Hoeveel gram h2o en c3h6 kan worden gevormd uit 6 c3h8o?
2C3H8O + 9O2 -> 6CO2 + 8H2O
Uit de uitgebalanceerde chemische vergelijking kunnen we zien dat voor elke 2 mol C3H8O die reageert, er 8 mol H2O wordt geproduceerd. Daarom zal 6 mol C3H8O 6 * 8 =48 mol H2O produceren.
De molaire massa van H2O is 18 g/mol. Daarom heeft 48 mol H2O een massa van 48 * 18 =864 g.
De uitgebalanceerde chemische vergelijking laat ook zien dat voor elke 2 mol C3H8O die reageert, er 6 mol CO2 wordt geproduceerd. Daarom zal 6 mol C3H8O 6 * 3 =18 mol CO2 produceren.
De molmassa van CO2 bedraagt 44 g/mol. Daarom heeft 18 mol CO2 een massa van 18 * 44 =792 g.
Daarom zal de verbranding van 6 mol C3H8O 864 g H2O en 792 g CO2 produceren.
 Autonome syntheserobot gebruikt AI om chemische ontdekkingen te versnellen
Autonome syntheserobot gebruikt AI om chemische ontdekkingen te versnellen  Wat is de normaliteit van 0,1 N acetaat?
Wat is de normaliteit van 0,1 N acetaat?  Nieuwe microscopie werkt bij extreme hitte, werpt licht op legeringen voor kernreactoren
Nieuwe microscopie werkt bij extreme hitte, werpt licht op legeringen voor kernreactoren Welke factor is de belangrijkste die bepaalt of water een vaste vloeistof of een gas is?
Welke factor is de belangrijkste die bepaalt of water een vaste vloeistof of een gas is?  Hoe het iso-elektrisch punt te berekenen
Hoe het iso-elektrisch punt te berekenen
 Droogte in het Amazone-regenwoud kan tot 18 maanden van tevoren worden voorspeld
Droogte in het Amazone-regenwoud kan tot 18 maanden van tevoren worden voorspeld Snelwegen in Brazilië zorgen voor ontwikkeling en vernietiging van Amazone
Snelwegen in Brazilië zorgen voor ontwikkeling en vernietiging van Amazone Internationale SWOT-missie kan de voorspelling van overstromingen verbeteren
Internationale SWOT-missie kan de voorspelling van overstromingen verbeteren  Smog in China keert terug nadat pandemie de lucht had geklaard
Smog in China keert terug nadat pandemie de lucht had geklaard In de diepe zee, de laatste ijstijd is nog niet voorbij
In de diepe zee, de laatste ijstijd is nog niet voorbij
Hoofdlijnen
- Begrijpen hoe cellen obstakels vermijden tijdens het navigeren door complexe omgevingen
- Nachtsnacks van vleermuizen onthullen aanwijzingen voor het beheer van bedreigde diersoorten
- Kan koraal onze oceanen redden? Onderzoekers ontdekken dat zacht weefsel riffen kan helpen beschermen
- Bijen en vlinders gaan achteruit in westelijk en zuidelijk Noord-Amerika
- Wat at T. rex? Elkaar
- Nieuw onderzoek helpt de genetische basis te verklaren waarom we er zo uitzien
- Robot ‘leert’ hoe te functioneren in menselijke omgevingen
- Trucs voor het onthouden van dieren Phylum
- Inside story:hoe de Russen de e-mails van de Democraten hackten
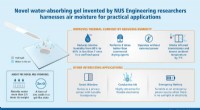
- Nieuwe hydrogel benut luchtvochtigheid voor praktische toepassingen
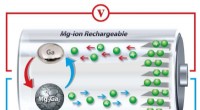
- Zelfherstellende vloeistof brengt nieuw leven in batterijalternatief
- Gefermenteerde zuivelproducten beter laten smaken

- Mensenhaar gebruikt om flexibele displays voor slimme apparaten te maken

- Onderzoekers creëren een 3D-geprinte slimme gel die onder water loopt, beweegt objecten

 Grote databases gebruiken om supergeleiders van de toekomst te vinden
Grote databases gebruiken om supergeleiders van de toekomst te vinden 'S Werelds langste spoorbaan van sauropod-dinosaurussen aan het licht gebracht
'S Werelds langste spoorbaan van sauropod-dinosaurussen aan het licht gebracht Wat is de toestand van de materie?
Wat is de toestand van de materie?  Het mysterie waarom nanodeeltjes van Ag-Rh-legeringen een vergelijkbare eigenschap hebben als Pd
Het mysterie waarom nanodeeltjes van Ag-Rh-legeringen een vergelijkbare eigenschap hebben als Pd Waar zijn alle palingen uit het meer gebleven? vraagt de prof van Queen
Waar zijn alle palingen uit het meer gebleven? vraagt de prof van Queen  Uit onderzoek blijkt dat ouderlijke hulp bij huiswerk geen invloed heeft op de prestaties van leerlingen
Uit onderzoek blijkt dat ouderlijke hulp bij huiswerk geen invloed heeft op de prestaties van leerlingen Microreactor voor synthese met Grignard-reagentia
Microreactor voor synthese met Grignard-reagentia Onderzoekers ontdekken hoe CRISPR-eiwitten hun doelwit vinden
Onderzoekers ontdekken hoe CRISPR-eiwitten hun doelwit vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

