
Wetenschap
Waarom verandert fenolftaleïne van kleur bij alkalische pH?
In zure oplossingen komt fenolftaleïne voor in zijn geprotoneerde vorm, die kleurloos is. De geprotoneerde vorm van fenolftaleïne heeft een chemische structuur waarbij de hydroxylgroep (-OH) op het centrale koolstofatoom is geprotoneerd, waardoor een -OH2+ groep wordt gevormd. Deze protonering voorkomt de vorming van het gekleurde anion.
Wanneer fenolftaleïne aan een alkalische oplossing wordt toegevoegd, zorgt de hoge concentratie hydroxide-ionen (OH-) ervoor dat het proton op de hydroxylgroep wordt verwijderd. Deze deprotonering leidt tot de vorming van het fenolftaleïne-anion, dat een rozerode kleur heeft. Het fenolftaleïne-anion heeft een gedelokaliseerde negatieve lading die zich over het molecuul uitstrekt, wat resulteert in de absorptie van licht in het zichtbare gebied van het spectrum, waardoor het de rozerode kleur krijgt.
De kleurverandering van fenolftaleïne bij alkalische pH is een resultaat van het chemische evenwicht dat bestaat tussen de geprotoneerde en gedeprotoneerde vormen van de verbinding. Bij hogere pH-waarden verschuift het evenwicht naar de gedeprotoneerde vorm, wat leidt tot een intensere rozerode kleur.
Samenvattend verandert fenolftaleïne van kleur bij een alkalische pH vanwege de deprotonering van de hydroxylgroep, wat leidt tot de vorming van het gekleurde fenolftaleïne-anion. Deze verandering in de moleculaire structuur resulteert in de absorptie van licht in het zichtbare gebied, waardoor de oplossing een rozerode kleur krijgt.
 Laat zien hoe elke sterke elektrolyt uiteenvalt in zijn samenstellende ionen bij het oplossen in water NaBr?
Laat zien hoe elke sterke elektrolyt uiteenvalt in zijn samenstellende ionen bij het oplossen in water NaBr?  Hoe extraheer je benzaldehyde uit olie van bittere amandelen?
Hoe extraheer je benzaldehyde uit olie van bittere amandelen?  Nieuwe techniek kan een revolutie teweegbrengen in de nauwkeurigheid en detectie van biomechanische veranderingen van cellen
Nieuwe techniek kan een revolutie teweegbrengen in de nauwkeurigheid en detectie van biomechanische veranderingen van cellen Welke stoffen maken ijs langzamer smelten?
Welke stoffen maken ijs langzamer smelten?  Waarom is het smeltpunt van p-chloorfenol hoger dan dat van o-chloorfenol?
Waarom is het smeltpunt van p-chloorfenol hoger dan dat van o-chloorfenol?
 Onderzoek naar kwikverontreiniging in de South River in Virginia
Onderzoek naar kwikverontreiniging in de South River in Virginia Staan we op een omslagpunt als het gaat om onkruidbestrijding?
Staan we op een omslagpunt als het gaat om onkruidbestrijding?  Onderzoek onthult volledige impact van breuken voor schaliegaswinning
Onderzoek onthult volledige impact van breuken voor schaliegaswinning Historische klimaateffecten van permafrost-veengebieden verrassen onderzoekers
Historische klimaateffecten van permafrost-veengebieden verrassen onderzoekers Bacteriën in de donkere oceaan blijken een grote rol te spelen bij het vastleggen van koolstof
Bacteriën in de donkere oceaan blijken een grote rol te spelen bij het vastleggen van koolstof
Hoofdlijnen
- Ik was hier eerst! Hoe hepatitis C E
- Mondiale meta-analyse kwantificeert de voordelen van het gebruik van bodembedekking
- Wat bepaalt de productie van eiwitten in uw lichaam?
- Hoe planten vergeten:Nieuw werk onthult hoe epigenetische kenmerken specifiek in sperma worden gereset
- De drie manieren waarop een RNA-molecuul structureel verschilt van een DNA-molecule
- Geen designerbaby’s, maar genbewerking om ziekten te voorkomen? Misschien
- Hoeveel zintuigen heeft een mens?
- Staan we allemaal af van een gemeenschappelijke vrouwelijke voorouder?
- Hoe planten bossig worden of niet:nieuw onderzoek werpt licht op het hormoon dat de vertakking regelt
- Onderzoekers ontwikkelen nieuwe strategie voor efficiënte OLED-schermen met actieve matrix

- Zoete lysine-afbraak
- Wetenschappers ontdekken hoe malariaparasieten suiker importeren
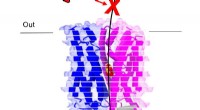
- Upcycling van plastic afval tot hoogwaardige mechanische smeermiddelen

- Singlet-zuurstof breekt selectief oxytetracycline af in fenton-achtige oxidatie

 Nee, we zullen de bedrijfswereld niet veranderen met desinvesteringen en boycots
Nee, we zullen de bedrijfswereld niet veranderen met desinvesteringen en boycots Kanker kan nauwkeurig worden gediagnosticeerd met behulp van een urinetest met kunstmatige intelligentie
Kanker kan nauwkeurig worden gediagnosticeerd met behulp van een urinetest met kunstmatige intelligentie Geen 'superbugs' meer? Ahornsiroopextract versterkt de antibiotische werking
Geen 'superbugs' meer? Ahornsiroopextract versterkt de antibiotische werking  Kolossale vondst van dinosaurusbot in Frankrijk maakt wetenschappers enthousiast
Kolossale vondst van dinosaurusbot in Frankrijk maakt wetenschappers enthousiast Genomische analyse van een soort zoöplankton stelt aannames over soortvorming en genregulatie in vraag
Genomische analyse van een soort zoöplankton stelt aannames over soortvorming en genregulatie in vraag  Wat zal er in de toekomst gebeuren met baobabbomen in Madagaskar?
Wat zal er in de toekomst gebeuren met baobabbomen in Madagaskar?  Onderzoekers bedenken nieuwe strategie om naar oude zwarte gaten te zoeken
Onderzoekers bedenken nieuwe strategie om naar oude zwarte gaten te zoeken We hebben een gezond ruimtevaartuig:NASA slaagt in historische flyby van verre wereld
We hebben een gezond ruimtevaartuig:NASA slaagt in historische flyby van verre wereld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

