
Wetenschap
Hoe verklaren de elektronenstructuur van het atoom en de emissiespectra de kleur van divers vuurwerk?
De elektronenstructuur van een atoom bepaalt zijn chemische eigenschappen en zijn emissiespectrum. Het emissiespectrum van een atoom is het unieke patroon van golflengten van licht dat het atoom uitzendt wanneer zijn elektronen worden opgewonden naar hogere energieniveaus en vervolgens terugvallen naar hun oorspronkelijke energieniveaus.
Hoe de elektronenstructuur kleur verklaart
Verschillende elementen zenden verschillende kleuren licht uit omdat ze verschillende elektronenstructuren hebben. De energieniveaus van de elektronen van een atoom worden bepaald door het aantal protonen in de kern en het aantal elektronen in het atoom. Wanneer een elektron wordt opgewonden tot een hoger energieniveau, absorbeert het een lichtfoton met dezelfde hoeveelheid energie als het verschil tussen de twee energieniveaus. Wanneer het elektron terugvalt naar zijn oorspronkelijke energieniveau, zendt het een foton licht uit met dezelfde hoeveelheid energie.
De golflengte van een foton van licht is omgekeerd evenredig met zijn energie. Dit betekent dat fotonen met kortere golflengten meer energie hebben dan fotonen met langere golflengten. De kleuren van het zichtbare spectrum zijn gerangschikt van rood (langste golflengte) tot violet (kortste golflengte).
Verschillende elementen zenden verschillende kleuren licht uit omdat ze verschillende elektronenstructuren hebben. Dit betekent dat de energieniveaus van hun elektronen verschillend zijn en dat ze fotonen van licht met verschillende golflengten absorberen en uitzenden.
Voorbeelden van elektronenstructuur en kleur
Hier zijn enkele voorbeelden van hoe de elektronenstructuur de kleur van verschillende soorten vuurwerk verklaart:
* Natrium atomen zenden geeloranje licht uit omdat hun elektronen bij verhitting naar een hoger energieniveau worden opgewonden. Dit energieniveau ligt ongeveer 2,1 elektronvolt (eV) boven het oorspronkelijke energieniveau. Wanneer de elektronen terugvallen naar hun oorspronkelijke energieniveau, zenden ze een lichtfoton uit met een golflengte van ongeveer 589 nm, wat zich in het geeloranje deel van het zichtbare spectrum bevindt.
* Koper atomen zenden groen licht uit omdat hun elektronen bij verhitting naar een hoger energieniveau worden opgewonden. Dit energieniveau ligt ongeveer 2,9 eV boven het oorspronkelijke energieniveau. Wanneer de elektronen terugvallen naar hun oorspronkelijke energieniveau, zenden ze een lichtfoton uit met een golflengte van ongeveer 522 nm, wat zich in het groene deel van het zichtbare spectrum bevindt.
* Strontium atomen zenden rood licht uit omdat hun elektronen bij verhitting naar een hoger energieniveau worden opgewonden. Dit energieniveau ligt ongeveer 1,8 eV boven het oorspronkelijke energieniveau. Wanneer de elektronen terugvallen naar hun oorspronkelijke energieniveau, zenden ze een lichtfoton uit met een golflengte van ongeveer 688 nm, wat zich in het rode deel van het zichtbare spectrum bevindt.
Conclusie
De elektronenstructuur van een atoom bepaalt zijn emissiespectrum en zijn kleur. Dit is de reden waarom verschillende elementen verschillende kleuren licht uitstralen wanneer ze worden verwarmd of opgewonden. Deze kennis wordt gebruikt om vuurwerk te maken dat een verscheidenheid aan prachtige kleuren produceert.
 Wat is de oplosbaarheid van ureum in water van 25 graden Celsius?
Wat is de oplosbaarheid van ureum in water van 25 graden Celsius?  Wat gebeurt er met pyruvaat onder anaërobe omstandigheden?
Wat gebeurt er met pyruvaat onder anaërobe omstandigheden?  Licht schijnend op de dynamiek van de aangeslagen toestand in perovskietmaterialen
Licht schijnend op de dynamiek van de aangeslagen toestand in perovskietmaterialen Computersimulaties geven inzicht in hoe koolstofdioxide reageert met een sekwestrerende vloeistof
Computersimulaties geven inzicht in hoe koolstofdioxide reageert met een sekwestrerende vloeistof  Onderzoeksteam ontwikkelt poreus sponsmateriaal voor het verbeteren van de hemostase en het herstel van de nieren
Onderzoeksteam ontwikkelt poreus sponsmateriaal voor het verbeteren van de hemostase en het herstel van de nieren
 Mysterie opgelost toen Australische duikboot na 103 jaar werd gevonden
Mysterie opgelost toen Australische duikboot na 103 jaar werd gevonden Nieuw juni-record voor ontbossing Braziliaanse Amazone
Nieuw juni-record voor ontbossing Braziliaanse Amazone Tropische storm Cristobal nadert richting Amerikaanse Golfkust
Tropische storm Cristobal nadert richting Amerikaanse Golfkust Hoe te identificeren Utah Knaagdieren
Hoe te identificeren Utah Knaagdieren  Opwarming van de aarde blijkt aanleiding te geven tot eerdere lentes die bijdragen aan drogere zomers
Opwarming van de aarde blijkt aanleiding te geven tot eerdere lentes die bijdragen aan drogere zomers
Hoofdlijnen
- Hoe lang kunnen virussen op oppervlakken leven?
- Hoe jasmonaatsignalering wordt verbeterd onder fosforarme omstandigheden in de plantenfysiologie
- Wat zijn de overeenkomsten en verschillen tussen menselijke cellen van bacteriën?
- Onderzoeker rapporteert belangrijke componenten van antivirale verdediging van honingbijen
- Twee vormen van c6h1206 die eenvoudige suikers zijn:glucose en?
- Hoe de percentages van adenine in een DNA-streng te berekenen
- Niveaus van celorganisatie
- Het gebit van de wedgefish lijkt ontworpen om schaaldieren te pletten, maar hij eet ook pijlstaartroggen
- Ontdekking zet het model op zijn kop voor hoe delende cellen de gelijke verdeling van hun chromosomen controleren
- Het nabootsen van het beste medicijn van de natuur opent de deur naar nieuwe behandelingen

- Vloeistoffen tot het uiterste drijven met simulatiemethoden voor materialen van de volgende generatie
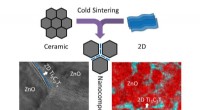
- Atomair dunne materialen sinteren met keramiek nu mogelijk
- Onderzoekers ontwikkelen moleculaire assemblagemethode voor kankertherapie en diagnostiek
- Perovskietmaterialen:Neutronen tonen twinning in halide perovskieten

 Nieuwe technologie kan prothesehanden gemakkelijker maken voor patiënten om te gebruiken
Nieuwe technologie kan prothesehanden gemakkelijker maken voor patiënten om te gebruiken Tijdomkering van een onbekende kwantumtoestand
Tijdomkering van een onbekende kwantumtoestand Wetenschapper stelt nieuwe definitie van planeet voor
Wetenschapper stelt nieuwe definitie van planeet voor Chemische eigenschappen van benzoëzuur
Chemische eigenschappen van benzoëzuur Kevers zorgen voor ontwikkeling van kleurveranderende nanodeeltjes voor commercieel gebruik
Kevers zorgen voor ontwikkeling van kleurveranderende nanodeeltjes voor commercieel gebruik Hoe het percentage van een cijfer te berekenen
Hoe het percentage van een cijfer te berekenen  Nieuwe mogelijkheden voor het detecteren van Hawking-straling uitgezonden door oerzwarte gaten
Nieuwe mogelijkheden voor het detecteren van Hawking-straling uitgezonden door oerzwarte gaten Waarom zien mitochondriën eruit zoals ze eruit zien?
Waarom zien mitochondriën eruit zoals ze eruit zien?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

