
Wetenschap
Wat is een manier om valentie-elektronen in een ionische verbinding bij te houden?
Na Cl
. .
. .
Het natriumatoom heeft één valentie-elektron, dat wordt weergegeven door de stip aan de linkerkant van het natriumsymbool. Het chlooratoom heeft zeven valentie-elektronen, die worden weergegeven door de zeven stippen aan de rechterkant van het chloorsymbool.
Het totale aantal valentie-elektronen in een ionische verbinding is gelijk aan de som van de valentie-elektronen van alle atomen in de verbinding. In het geval van natriumchloride is het totale aantal valentie-elektronen 8 (1 valentie-elektron uit natrium + 7 valentie-elektronen uit chloor).
De Lewis-puntstructuur kan worden gebruikt om de lading van een ion te bepalen. De lading van een ion wordt bepaald door het verschil tussen het aantal valentie-elektronen en het aantal protonen in het ion. In het geval van natriumchloride heeft het natriumion bijvoorbeeld een lading van +1 omdat het één valentie-elektron en 11 protonen heeft. Het chloride-ion heeft een lading van -1 omdat het zeven valentie-elektronen en 17 protonen heeft.
 Wetenschappers identificeren potentieel vaccindoelwit voor steeds meer bacteriestammen
Wetenschappers identificeren potentieel vaccindoelwit voor steeds meer bacteriestammen Door nieuwe technologie kunnen belangrijke metalen efficiënter worden gemaakt
Door nieuwe technologie kunnen belangrijke metalen efficiënter worden gemaakt Welke 3 protonen en 2 elektronen laden op?
Welke 3 protonen en 2 elektronen laden op?  Welk type kracht is een covalente binding?
Welk type kracht is een covalente binding?  De conversiefactoren inherent aan chemische formules
De conversiefactoren inherent aan chemische formules
 Wat zijn klimplanten?
Wat zijn klimplanten?  Terugtrekkend meer van Malawi legt de kosten van klimaatverandering bloot
Terugtrekkend meer van Malawi legt de kosten van klimaatverandering bloot EU-waterbommenwerpers strijden tegen natuurbrand op Grieks eiland
EU-waterbommenwerpers strijden tegen natuurbrand op Grieks eiland In de Siërra, wetenschappers wedden op overlevende bomen om droogte en klimaatverandering te weerstaan
In de Siërra, wetenschappers wedden op overlevende bomen om droogte en klimaatverandering te weerstaan Als de dennen verdwijnen, kan het dan nog steeds Big Pine Key heten?
Als de dennen verdwijnen, kan het dan nog steeds Big Pine Key heten?
Hoofdlijnen
- Een endemische eilandvalk die speelt
- Hoe evolutie werkt
- Hoe werkt hennep?
- Wetenschappers vergroten het inzicht in hoe bloemen worden gevormd
- Making Better Humans - Het huwelijk van mens en machine
- Selenium zou de sleutel kunnen zijn tot het mysterie van kribbebijten bij paarden
- Hoe nuttig zijn volwassen stamcellen eigenlijk?
- Mannelijke dolfijnen bieden geschenken aan om vrouwtjes aan te trekken
- Vogelgriep bevestigd bij melkkoeien in Colorado naarmate de uitbraak zich verspreidt
- Hoe melk een dierlijk lichaam goed doet?

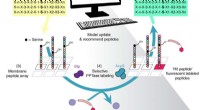
- Machine learning gebruiken om peptiden te ontwerpen
- Wetenschappers kweken snel een DKDP-kristal met lange zaden

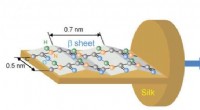
- Nieuwe infraroodbeeldvormingstechniek onthult moleculaire oriëntatie van eiwitten in zijdevezels
- Mensen inspireren om betere levensstijlkeuzes te maken - door middel van isotopen

 Voorgestelde methode voor nauwkeurigere bepalingen van neutronensterstralen
Voorgestelde methode voor nauwkeurigere bepalingen van neutronensterstralen Veelbelovend nieuw materiaal heeft de juiste eigenschappen om zonne-energie op te vangen, water splitsen in waterstof en zuurstof
Veelbelovend nieuw materiaal heeft de juiste eigenschappen om zonne-energie op te vangen, water splitsen in waterstof en zuurstof Blauwe fosfor:hoe een halfgeleider een metaal wordt
Blauwe fosfor:hoe een halfgeleider een metaal wordt Mechanische eigenschappen van zacht staal
Mechanische eigenschappen van zacht staal Uit onderzoek blijkt hoe de luchtstroom in een auto het risico op overdracht van COVID-19 kan beïnvloeden
Uit onderzoek blijkt hoe de luchtstroom in een auto het risico op overdracht van COVID-19 kan beïnvloeden  Vijf redenen waarom zelfrijdende auto's niet snel zullen komen
Vijf redenen waarom zelfrijdende auto's niet snel zullen komen Emissies stegen in 2018 met een onhoudbare 2%:studie
Emissies stegen in 2018 met een onhoudbare 2%:studie Nieuw ontdekte gebouwen onthullen aanwijzingen voor oude Egyptische dynastieën
Nieuw ontdekte gebouwen onthullen aanwijzingen voor oude Egyptische dynastieën
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

