
Wetenschap
Waarom kan een waterstofbrug oplossen in water?
Oplossen verwijst naar het proces waarbij een vaste, vloeibare of gasvormige opgeloste stof oplost in een vloeibaar oplosmiddel om een homogeen mengsel te vormen dat een oplossing wordt genoemd. Het vermogen van een stof om in een oplosmiddel op te lossen hangt af van de chemische en fysische eigenschappen van zowel de opgeloste stof als het oplosmiddel. Water is een polair oplosmiddel, wat betekent dat het een gedeeltelijk positieve lading heeft aan het ene uiteinde van het molecuul en een gedeeltelijk negatieve lading aan het andere uiteinde. Hierdoor kunnen watermoleculen waterstofbruggen vormen met andere polaire moleculen of moleculen waarbij waterstofatomen gebonden zijn aan elektronegatieve atomen. Stoffen die waterstofbruggen kunnen vormen met water zijn over het algemeen oplosbaar in water.
 Pervaporatiemembranen zijn veelbelovend voor de terugwinning van alkalisch afvalwater
Pervaporatiemembranen zijn veelbelovend voor de terugwinning van alkalisch afvalwater  Hoe aromatisch opgelost organisch materiaal de adsorptie van organische microverontreinigingen beïnvloedt
Hoe aromatisch opgelost organisch materiaal de adsorptie van organische microverontreinigingen beïnvloedt  Onderzoek peilt naar de moleculaire bouwstenen voor lichtgevoelige materialen
Onderzoek peilt naar de moleculaire bouwstenen voor lichtgevoelige materialen Nieuwe katalysatoren verwijderen BPA efficiënt en snel uit water
Nieuwe katalysatoren verwijderen BPA efficiënt en snel uit water Een zeer gevoelig SERS-substraat voor gasdetectie
Een zeer gevoelig SERS-substraat voor gasdetectie
 Californische kreekbrand creëert zijn eigen pyrocumulonimbus-wolk
Californische kreekbrand creëert zijn eigen pyrocumulonimbus-wolk Hoe vooroordelen tot uiting komen in kaarten gemaakt met burgerwetenschappelijke gegevens
Hoe vooroordelen tot uiting komen in kaarten gemaakt met burgerwetenschappelijke gegevens  Wat zijn drie aanpassingen die reptielen hebben voor het behoud van water?
Wat zijn drie aanpassingen die reptielen hebben voor het behoud van water?  Een klimaat in crisis vraagt om investeringen in directe luchtafvang, nieuws onderzoek vindt
Een klimaat in crisis vraagt om investeringen in directe luchtafvang, nieuws onderzoek vindt Herzien model voor aardbevingsgevaar helpt Aotearoa, Nieuw-Zeeland de veerkracht te vergroten
Herzien model voor aardbevingsgevaar helpt Aotearoa, Nieuw-Zeeland de veerkracht te vergroten
Hoofdlijnen
- Video:Waarom vechten we nog steeds tegen tuberculose?
- Gist kan worden ontwikkeld om eiwitgeneesmiddelen te maken
- Waarom het idee dat het Engels een gemeenschappelijke Angelsaksische oorsprong heeft, een mythe is
- Wat doen de cilia en flagellen in een cel?
- Hoe slim te zijn:top 5 manieren om slimmer te worden
- Wat zijn de kenmerken van een cel die een interfase ondergaat?
- Met behulp van neutronen bestuderen hoe resistente bacteriën evolueren
- Onderzoekers ontrafelen het eeuwenoude mysterie waarom cellen fermentatie gebruiken
- Grazende paarden op betere weiden
- Wat spoelwormen ons kunnen leren over menselijke groei?
- Nieuwe theorie laat zien hoe spanning zorgt voor betere katalysatoren
- Metalen nanodeeltjes verlichten een andere weg naar milieuvriendelijke katalysatoren
- Mensen inspireren om betere levensstijlkeuzes te maken - door middel van isotopen

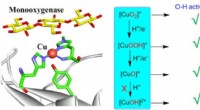
- Theoretisch perspectief op C-H/O-H activering door Cu-O in biologische en synthetische systemen
 Waarom maken bijen minder honing? Studie onthult aanwijzingen uit vijf decennia aan gegevens
Waarom maken bijen minder honing? Studie onthult aanwijzingen uit vijf decennia aan gegevens  Nanofotonica-technologie maakt een nieuw soort optische spectrometer mogelijk
Nanofotonica-technologie maakt een nieuw soort optische spectrometer mogelijk Nieuw IR-instrument zoekt naar bewoonbare planeten
Nieuw IR-instrument zoekt naar bewoonbare planeten Van toilet tot steenbakkerij:recyclen van biosolids om duurzame bakstenen te maken
Van toilet tot steenbakkerij:recyclen van biosolids om duurzame bakstenen te maken Goudlokje-systeem verhoogt de efficiëntie van nikkel-gekatalyseerde reacties
Goudlokje-systeem verhoogt de efficiëntie van nikkel-gekatalyseerde reacties  Zoeken naar axion donkere materie met een nieuw detectieapparaat
Zoeken naar axion donkere materie met een nieuw detectieapparaat Wetenschappers gebruiken kunstmatige intelligentie om zwaartekrachtsgolven te detecteren
Wetenschappers gebruiken kunstmatige intelligentie om zwaartekrachtsgolven te detecteren Het wanneer, waar en wat van blootstelling aan luchtverontreinigende stoffen
Het wanneer, waar en wat van blootstelling aan luchtverontreinigende stoffen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

