
Wetenschap
Is het gemakkelijker om een elektron te verwijderen uit een jodide-ion of een bromide-ion?
Dit komt omdat het jodide-ion een grotere elektronenwolk heeft dan het bromide-ion. Dit betekent dat de elektronen in het jodide-ion meer verspreid zijn en daardoor minder strak aan de kern gebonden zijn. Als gevolg hiervan is het gemakkelijker om een elektron uit een jodide-ion te verwijderen dan uit een bromide-ion.
Hoe groter de grootte van het anion, hoe gemakkelijker het is om een elektron te verwijderen.
Dit komt omdat de valentie-elektronen verder van de kern verwijderd zijn en er daarom minder door aangetrokken worden.
De trend in ionisatie-energie voor de halogenen is:
F> Cl> Br> I
Dit betekent dat het het gemakkelijkst is om een elektron uit een jodide-ion te verwijderen en het moeilijkst om een elektron uit een fluoride-ion te verwijderen.
 Nieuw model voorspelt een toename van stofstormen in de VS
Nieuw model voorspelt een toename van stofstormen in de VS Het COVID-19-herstel in Afrika moet de voordelen van natuur en natuurbehoud benutten
Het COVID-19-herstel in Afrika moet de voordelen van natuur en natuurbehoud benutten Aziatische steden worden geconfronteerd met een perfecte storm van milieugevaren
Aziatische steden worden geconfronteerd met een perfecte storm van milieugevaren Een verband tussen streng winterweer en Arctische warmte?
Een verband tussen streng winterweer en Arctische warmte?  Radioactieve koolstof van atoombomtests gevonden in diepe oceaantroggen
Radioactieve koolstof van atoombomtests gevonden in diepe oceaantroggen
Hoofdlijnen
- Wat zijn enkele woorden om cellen a tot en met z te beschrijven?
- Zouden mensen bereid zijn hun persoonsgegevens af te staan voor onderzoek?
- Hoe de Wolbachia-bacterie vectoren van dodelijke ziekten controleert
- De nacht zit vol met dieren, maar wetenschappers weten er heel weinig van
- Hoe bacteriën wondgenezing ondersteunen
- Het vinden van het ritme van collectieve beweging van dieren:wetenschappers tonen aan dat wederkerigheid de sleutel is tot het aansturen van gecoördineerde bewegingen
- Wat zijn de twee hoofdfasen van celdeling?
- Laboratoriumexperimenten met hoge resolutie laten zien hoe cellen 'eten'
- Nieuwe studie benadrukt de effecten van een wereldwijde strategie om de antibioticaconsumptie in de productie van voedseldieren te verminderen
- Onderzoekers demonstreren de hoogste gerapporteerde geleidbaarheid voor organisch radicaalpolymeer
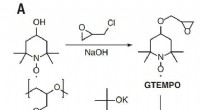
- Gevaarlijk wild gras zal worden gebruikt in batterijen

- Bluspoeder hergebruikt in meststoffen en brandvertragers

- Onderzoekers maken synthetische polymeren in levende cellen
- Wetenschappers vinden nieuwe technologie uit om de ontdekking van medicijnen te stroomlijnen

 Kleine goudmijnen in Senegal zorgen voor hoge kwikverontreiniging
Kleine goudmijnen in Senegal zorgen voor hoge kwikverontreiniging Wat zegt wat het resultaat van het experiment zal zijn?
Wat zegt wat het resultaat van het experiment zal zijn?  Trots en vooroordelen op grote hoogte
Trots en vooroordelen op grote hoogte Microplastics in de oceaan:eerste wereldbeeld toont seizoensveranderingen en bronnen
Microplastics in de oceaan:eerste wereldbeeld toont seizoensveranderingen en bronnen Wat is een eenvoudige truss
Wat is een eenvoudige truss  Collectieve ontvlechting van verstrengelde polymeren
Collectieve ontvlechting van verstrengelde polymeren Wanneer natuurkunde de evolutie een voorsprong geeft door er een te breken
Wanneer natuurkunde de evolutie een voorsprong geeft door er een te breken Het magnetisch veld van ons melkwegstelsel in kaart brengen
Het magnetisch veld van ons melkwegstelsel in kaart brengen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

