
Wetenschap
Waarom is 1-butyn zuur en 2-butyn niet?
De zuurgraad van een waterstofatoom houdt verband met de stabiliteit van de geconjugeerde base die wordt gevormd nadat het waterstofatoom is verwijderd. In het geval van 1-butyn is de geconjugeerde base een resonantie-gestabiliseerd carbanion. De negatieve lading in het carbanion kan worden gedelokaliseerd over beide koolstofatomen met drievoudige bindingen, wat helpt de soort te stabiliseren.
Daarentegen is de geconjugeerde base van 2-butyn niet zo stabiel. De negatieve lading in het carbanion kan niet zo effectief worden gedelokaliseerd over de twee koolstofatomen met drievoudige bindingen, wat betekent dat de soort minder stabiel is. Als gevolg hiervan is 2-butyn niet zuur genoeg om een proton te doneren bij typische zuur-base-reacties.
Het verschil in zuurgraad tussen 1-butyn en 2-butyn is te zien aan hun pKa-waarden. De pKa van 1-butyn is 23, terwijl de pKa van 2-butyn 26 is. Dit betekent dat 1-butyn een sterker zuur is dan 2-butyn.
De zuurgraad van alkynen kan ook worden beïnvloed door de aanwezigheid van andere functionele groepen. De aanwezigheid van een carbonylgroep nabij het alkyn kan bijvoorbeeld de zuurgraad van het alkyn verhogen. Dit komt omdat de carbonylgroep elektronen aan het alkyn kan onttrekken, waardoor de waterstofatomen op het alkyn zuurder worden.
 Hoe een 3D-atoomstructuur van zwavel
Hoe een 3D-atoomstructuur van zwavel Hoeveel mol NaOH zijn er nodig om 2 liter een 2,0 M oplossing te bereiden?
Hoeveel mol NaOH zijn er nodig om 2 liter een 2,0 M oplossing te bereiden?  Onderzoekers gebruiken ketylradicalen voor een nieuwe meercomponentenreactie
Onderzoekers gebruiken ketylradicalen voor een nieuwe meercomponentenreactie Nieuwe modelleringsaanpak helpt bij het ontwerpen van laserglas
Nieuwe modelleringsaanpak helpt bij het ontwerpen van laserglas Hoeveel ijzerascorbaat komt overeen met elementair ijzer 100 mg?
Hoeveel ijzerascorbaat komt overeen met elementair ijzer 100 mg?
 Om het klimaat te redden, koolstof belasten tegen $ 75 per ton:IMF
Om het klimaat te redden, koolstof belasten tegen $ 75 per ton:IMF Bodemporiën vormen de sleutel tot stabiliteit voor woestijnbodems
Bodemporiën vormen de sleutel tot stabiliteit voor woestijnbodems Hoe klimaatgrillen planten kunnen triggeren
Hoe klimaatgrillen planten kunnen triggeren  Impact van bombardementen uit de Tweede Wereldoorlog gevoeld aan de rand van de ruimte
Impact van bombardementen uit de Tweede Wereldoorlog gevoeld aan de rand van de ruimte Bosnische hoofdstad Sarajevo getroffen door gevaarlijke luchtvervuiling
Bosnische hoofdstad Sarajevo getroffen door gevaarlijke luchtvervuiling
Hoofdlijnen
- Hoe de neus van een baby de geur van mama kent
- De geplande massa-executie van ganzen in Conn. City werd stopgezet na een stortvloed aan gepassioneerde inbreng van beide kanten
- Wat doen mariene biologen precies?
- Natuur of opvoeding:hoe komt een dier aan zijn microbioom?
- Waarom hebben bladcellen zoveel bladgroenkorrels?
- Angiosperm versus Gymnosperm: wat zijn de overeenkomsten & verschillen?
- Waarom geven we de voorkeur aan bepaalde voedingsmiddelen boven andere?
- Hoe mosselen hun hechting onder water behouden
- Wat zijn nitraat-pH?
- Onderzoekers bedenken nieuw proces om suikers uit hout te extraheren

- Met metaaloxide doordrenkte membranen kunnen een energiezuinig alternatief bieden voor chemische scheidingen

- Zeer functioneel membraan ontwikkeld voor de productie van zoetwater uit zeewater
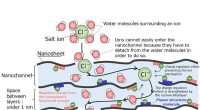
- Proces verwijdert tegelijkertijd giftige metalen en zout om schoon water te produceren

- Onderzoekers ontwikkelen nieuw clip-on-apparaat voor smartphones om sperma te analyseren
 Burgerwetenschappers ontdekken zeldzame kosmische koppeling
Burgerwetenschappers ontdekken zeldzame kosmische koppeling De meeste vroege onderzoekers in de natuurwetenschappen willen open access publiceren, maar lopen tegen financiële barrières aan
De meeste vroege onderzoekers in de natuurwetenschappen willen open access publiceren, maar lopen tegen financiële barrières aan Nieuwe algoritmen om eigentoestanden en thermische toestanden op kwantumcomputers te bepalen
Nieuwe algoritmen om eigentoestanden en thermische toestanden op kwantumcomputers te bepalen Negrigreen-gletsjer in beweging
Negrigreen-gletsjer in beweging Waarom ananasbladeren een veelbelovende kandidaat zijn ter vervanging van plastic materialen die worden gebruikt in maskers voor eenmalig gebruik
Waarom ananasbladeren een veelbelovende kandidaat zijn ter vervanging van plastic materialen die worden gebruikt in maskers voor eenmalig gebruik Vreemde reactie zorgt voor opschudding in het lab
Vreemde reactie zorgt voor opschudding in het lab Hoe het gebied van een 12-zijdige veelhoek te vinden
Hoe het gebied van een 12-zijdige veelhoek te vinden  Het jet/cocon-raadsel van een zwaartekrachtgolf oplossen
Het jet/cocon-raadsel van een zwaartekrachtgolf oplossen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

