
Wetenschap
Is deze chemische vergelijking correcte reacties ---- producten?
Beschouw de volgende reactie als voorbeeld:
2H2 + O2 → 2H2O
In deze vergelijking reageren 2 moleculen waterstofgas (H2) met 1 molecuul zuurstofgas (O2) om 2 moleculen water (H2O) te produceren. Als we de totale massa van de reactanten en producten berekenen, krijgen we:
Reagentia:2(2 g) + 1(32 g) =36 g
Producten:2(18 g) =36 g
Zoals je kunt zien is de totale massa van de reactanten gelijk aan de totale massa van de producten, dus wordt aan de wet van behoud van massa voldaan en is de vergelijking correct.
Het is echter belangrijk op te merken dat een uitgebalanceerde chemische vergelijking er alleen voor zorgt dat de wet van behoud van massa wordt gevolgd, maar niet garandeert dat de reactie daadwerkelijk zal plaatsvinden of dat deze onder de gespecificeerde omstandigheden zal verlopen. Factoren zoals reactiesnelheden, activeringsenergie en reactieomstandigheden spelen ook een rol bij het bepalen of een reactie zal plaatsvinden.
 Waarom er een dodelijke schaduw over de Everest-top hangt
Waarom er een dodelijke schaduw over de Everest-top hangt Klein maar krachtig:waarom microben deel kunnen uitmaken van klimaatoplossingen
Klein maar krachtig:waarom microben deel kunnen uitmaken van klimaatoplossingen  Criollo-vee:kan een oud ras het antwoord van de rundvleesindustrie zijn op de klimaatverandering?
Criollo-vee:kan een oud ras het antwoord van de rundvleesindustrie zijn op de klimaatverandering?  Vijf hotspots waar drijvend plastic zwerfvuil het grootste risico vormt voor het zeeleven in de Noord-Atlantische Oceaan
Vijf hotspots waar drijvend plastic zwerfvuil het grootste risico vormt voor het zeeleven in de Noord-Atlantische Oceaan  Klimaatimpact van wolken gemaakt van vliegtuigcontrails kan tegen 2050 verdrievoudigen
Klimaatimpact van wolken gemaakt van vliegtuigcontrails kan tegen 2050 verdrievoudigen
Hoofdlijnen
- Zou het hebben van een eigen kloon hetzelfde zijn als een eeneiige tweeling?
- Slapen spinnen? Onderzoek suggereert dat ze net als mensen kunnen snoozen
- Nieuwe inzichten in het gedrag van jonge doornenkroonsterren dat riffen bedreigt
- Celdeling in planten:hoe celwanden worden samengesteld
- Het ontdekken van de geheimen van hoe chromosomen assembleren
- Baby bongo geboren, waarschijnlijk binnenkort in Species Survival Center
- Percepties over wat er nodig is om te slagen in STEM-gebieden kunnen vrouwen buitensluiten
- Hebben mannen en vrouwen verschillende hersenen?
- Designer-molecuul wijst op behandeling voor ziekten veroorzaakt door DNA-herhalingen
- Zelfherstellende katalysatorfilms voor waterstofproductie

- Kleine robot kan game-changer zijn in de strijd tegen tuberculose
- Computationele studie laat zien hoe Ebola nucleocapside stabiliseert

- Waterstofproductie in een besloten ruimte
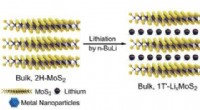
- Plantaardig afval spinnen tot koolstofvezel voor auto's, vliegtuigen
 Zara en H&M versterken verdediging terwijl internet dreigt
Zara en H&M versterken verdediging terwijl internet dreigt Stabiliteit door fluctuatie:topologische materialen presteren beter door kwantumperiodieke beweging
Stabiliteit door fluctuatie:topologische materialen presteren beter door kwantumperiodieke beweging Crowdfunding vult leemten op voor door virus verdreven werknemers
Crowdfunding vult leemten op voor door virus verdreven werknemers Synthese van nieuwe rode fosforen met een slim materiaal als gastheermateriaal
Synthese van nieuwe rode fosforen met een slim materiaal als gastheermateriaal Magisch blikje bij de staart grijpen
Magisch blikje bij de staart grijpen Wat voor soort lichaamsafdekkingen hebben amfibieën?
Wat voor soort lichaamsafdekkingen hebben amfibieën?  Hoe patriottische raketten werken
Hoe patriottische raketten werken  Mysterieus hoofd van een farao ontdekt
Mysterieus hoofd van een farao ontdekt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

