
Wetenschap
Bepaal de empirische formule voor het volgen van een verbinding gemaakt van 26,19 stikstof in massa, 7,55 waterstof en 66,26 chloor met een totaal molair gewicht van 53,50 g?
1. Converteer de gegeven massa naar mol:
Mol stikstof =26,19 g / 28,01 g/mol =0,935 mol
Mol waterstof =7,55 g / 1,008 g/mol =7,49 mol
Mol chloor =66,26 g / 35,45 g/mol =1,87 mol
2. Deel elk aantal mol door het kleinste aantal mol om de eenvoudigste verhouding van gehele getallen te krijgen:
0,935 mol / 0,935 mol =1
7,49 mol / 0,935 mol ≈ 8
1,87 mol / 0,935 mol ≈ 2
3. De eenvoudigste verhouding van gehele getallen is ongeveer 1:8:2.
4. Vermenigvuldig de subscripts van de elementen met een geschikte factor om hele getallen te verkrijgen. In dit geval kunnen we alle subscripts met 2 vermenigvuldigen om het volgende te krijgen:
2(1) =2
2(8) =16
2(2) =4
Daarom is de empirische formule voor de verbinding NH4Cl2.
 Onderzoek helpt bij het vaststellen wat soorten kwetsbaar maakt voor veranderingen in het milieu
Onderzoek helpt bij het vaststellen wat soorten kwetsbaar maakt voor veranderingen in het milieu  Nieuwe inzichten in hoe fytochromen planten helpen licht en temperatuur waar te nemen en erop te reageren
Nieuwe inzichten in hoe fytochromen planten helpen licht en temperatuur waar te nemen en erop te reageren  Verloren continenten gevonden diep onder de grond zo oud als de aarde werpen licht op de vorming van planeten
Verloren continenten gevonden diep onder de grond zo oud als de aarde werpen licht op de vorming van planeten Maar liefst 1,8 miljoen hectare verbrand in zeer ernstige branden tijdens de Black Summer van Australië
Maar liefst 1,8 miljoen hectare verbrand in zeer ernstige branden tijdens de Black Summer van Australië Nieuw inzicht in interactie tussen oceaan en atmosfeer en daaropvolgende wolkenvorming
Nieuw inzicht in interactie tussen oceaan en atmosfeer en daaropvolgende wolkenvorming
Hoofdlijnen
- Spinnen of brullen sabeltandtijgers? Het antwoord ligt misschien in een klein stukje bot
- Onderzoekers ontdekken toxine dat bacteriën op ongekende manieren doodt
- Is er eerder enige vorm van exploratie op Mercurius gedaan
- Wetenschappers hebben fundamentele ontdekkingen gedaan over de manier waarop eigenschappen van embryonale stamcellen worden gecontroleerd
- Koel als ijs:hoe nieuw onderzoek wetenschappers helpt cellen te behouden
- Onderzoekers vinden eerste wilde alligator brekende schildpad in Illinois sinds 1984
- Jurassic ichthyosaurussen verdeelden voedselbronnen om naast elkaar te bestaan, vinden onderzoekers
- Hoe bidsprinkhaankreeften de wereld begrijpen
- Hoe grotbiologie werkt
- Water zou de activiteit en selectiviteit van koolstofdioxidereductie kunnen moduleren
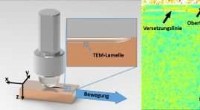
- Materiaalonderzoekers bestuderen de oorzaken van slijtage - permanente moleculaire modificaties treden op bij het eerste contact
- Ontziltingsonderzoek kan ingenieurs helpen om efficiënter schoon water te produceren
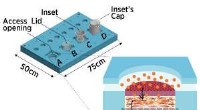
- Huid reconstrueren op een chip
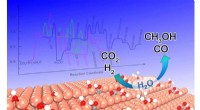
- Tethered chem combo's kunnen een revolutie teweegbrengen in kunstmatige fotosynthese

 Zou Venus bewoonbaar kunnen zijn?
Zou Venus bewoonbaar kunnen zijn?  grote vervoerders, staat AG's zullen werken om robocalls te bestrijden
grote vervoerders, staat AG's zullen werken om robocalls te bestrijden Een nieuw nanomateriaal voor de strijd tegen vervalsingen
Een nieuw nanomateriaal voor de strijd tegen vervalsingen 'S Werelds oudste handtekening van een christen staat in Basel
'S Werelds oudste handtekening van een christen staat in Basel Getijdencycli kunnen helpen bij het voorspellen van vulkaanuitbarstingen, studie suggereert:
Getijdencycli kunnen helpen bij het voorspellen van vulkaanuitbarstingen, studie suggereert: Gewelddadige misdaad is als een besmettelijke ziekte - en we weten hoe we de verspreiding ervan kunnen stoppen
Gewelddadige misdaad is als een besmettelijke ziekte - en we weten hoe we de verspreiding ervan kunnen stoppen Hoe u geld kunt verdienen op YouTube:insidertips voor het starten van een kanaal
Hoe u geld kunt verdienen op YouTube:insidertips voor het starten van een kanaal Welke microscopisch kleine bacteriën veranderen melk in yoghurt?
Welke microscopisch kleine bacteriën veranderen melk in yoghurt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

