
Wetenschap
Waarom is molariteit belangrijk in de chemie?
1. Kwantitatieve analyse:Molariteit maakt de nauwkeurige meting en vergelijking van de concentraties van oplossingen mogelijk. Hiermee kunnen scheikundigen de hoeveelheid opgeloste stof in een bepaald volume oplossing bepalen. Deze kwantitatieve informatie is essentieel voor verschillende chemische berekeningen, zoals stoichiometrie, titraties en evenwichtsstudies.
2. Stoichiometrie:Molariteit is van fundamenteel belang bij stoichiometrische berekeningen, waarbij de kwantitatieve relatie tussen reactanten en producten in chemische reacties wordt bepaald. Door de molariteit van de reactanten te kennen, kunnen scheikundigen het aantal mol van elke betrokken stof berekenen en stoichiometrische verhoudingen gebruiken om de producthoeveelheden te bepalen.
3. Voorbereiding van oplossingen:Molariteit is van vitaal belang bij het bereiden van oplossingen met specifieke concentraties. Chemici gebruiken molariteit om de benodigde hoeveelheid opgeloste stof nauwkeurig te wegen of te meten en deze op te lossen in een oplosmiddel om een oplossing met de gewenste concentratie te verkrijgen. Deze precisie is van cruciaal belang bij veel laboratoriumexperimenten en toepassingen.
4. Reactiesnelheden:Molariteit speelt een rol bij het bestuderen van reactiesnelheden en kinetiek. De snelheid van een chemische reactie hangt vaak af van de concentraties van de reactanten. Door de verandering in molariteit in de loop van de tijd te meten, kunnen scheikundigen de reactiesnelheid bepalen en de factoren onderzoeken die deze beïnvloeden.
5. Evenwichtsstudies:Molariteit is cruciaal bij het bestuderen van chemische evenwichten. Bij evenwicht blijven de concentraties van reactanten en producten constant. Door de molariteit van soorten in evenwicht te meten, kunnen scheikundigen evenwichtsconcentraties en evenwichtsconstanten bepalen, wat waardevolle inzichten oplevert in het gedrag van chemische systemen.
6. Zuur-base-chemie:Molariteit is essentieel bij zuur-base-titraties, waarbij de reactie van een zuur en een base betrokken is om hun concentraties te bepalen. Door een base met een bekende molariteit aan een zure oplossing toe te voegen, kunnen scheikundigen de concentratie van het zuur berekenen op basis van de volumes en molariteiten van de reactanten.
7. Colligatieve eigenschappen:Molariteit houdt verband met colligatieve eigenschappen van oplossingen, zoals kookpuntverhoging en vriespuntverlaging. Colligatieve eigenschappen zijn afhankelijk van de concentratie van opgeloste deeltjes, en molariteit biedt een handige manier om de concentratie van deeltjes in oplossing te kwantificeren.
8. Standaardisatie:Molariteit is cruciaal bij de standaardisatie van oplossingen. Standaardoplossingen met nauwkeurig bekende concentraties worden gebruikt om laboratoriuminstrumenten en reagentia te kalibreren. Molariteit maakt een nauwkeurige bepaling van de concentratie van deze standaardoplossingen mogelijk.
Over het algemeen is molariteit een fundamenteel concept in de chemie dat nauwkeurige metingen, berekeningen en analyse van oplossingen mogelijk maakt. Het speelt een cruciale rol op verschillende gebieden van de chemie, van kwantitatieve analyse tot reactiekinetiek, evenwichtsstudies en praktische toepassingen in het laboratorium.
Hoofdlijnen
- Welke soorten cellen zijn bacteriën?
- Waarom worden algoritmen algoritmen genoemd? Een korte geschiedenis van de Perzische polymath die je waarschijnlijk nog nooit hebt gehoord
- Spelen met de kinderen is belangrijk werk voor chimpanseemoeders
- Is het ribosoom een plantaardige of dierlijke structuur?
- Hoe het signaal van licht biologische actie in bacteriën teweegbrengt
- Indringende vraag:Wat doodt de honingbijen?
- Computersimulatie verklaart waarom zebra's strepen hebben
- Welk aminozuur is aanwezig in wateroplosbaar globulair eiwit?
- Met uitsterven bedreigde mus in Centraal-Florida die in het wild waarschijnlijk niet zal overleven
- Spinout wil het testen van voedselveiligheid transformeren

- Nieuw type binnenzonnecellen voor slimme verbonden apparaten

- Het opruimen van Tsjernobyl kan worden geholpen door een nieuwe benadering voor röntgenanalyse

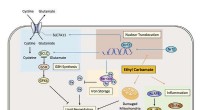
- Wetenschappers ontdekken het mechanisme voor ethylcarbamaat-geïnduceerde toxiciteit in gefermenteerd voedsel
- Onderzoekers reproduceren Great Wave-schilderij op microschaal met inktloze technologie

 Vraag en antwoord:een beter lokaal tsunami-waarschuwingssysteem ontwerpen
Vraag en antwoord:een beter lokaal tsunami-waarschuwingssysteem ontwerpen Een nieuwe uitvoering van het CLOUD-experiment onderzoekt het directe effect van kosmische straling op wolken
Een nieuwe uitvoering van het CLOUD-experiment onderzoekt het directe effect van kosmische straling op wolken Kunnen twee NASA-astronauten tot volgend jaar vastzitten in het ruimtestation? Dit is wat u moet weten
Kunnen twee NASA-astronauten tot volgend jaar vastzitten in het ruimtestation? Dit is wat u moet weten  Complex leven is ontstaan uit de toevallige koppeling van kleine moleculen
Complex leven is ontstaan uit de toevallige koppeling van kleine moleculen Visionair of gek? Zuckerberg over zijn uitgavengolf
Visionair of gek? Zuckerberg over zijn uitgavengolf  Hoe stille signalen van je telefoon je kunnen opnemen en volgen
Hoe stille signalen van je telefoon je kunnen opnemen en volgen Het geheim om uit de armoede te komen
Het geheim om uit de armoede te komen Onderzoek naar de manier waarop planten suikers transporteren kan van cruciaal belang zijn in de opwarming van de aarde
Onderzoek naar de manier waarop planten suikers transporteren kan van cruciaal belang zijn in de opwarming van de aarde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


