
Wetenschap
Een eenvoudige en robuuste methode om functionele moleculen aan peptiden toe te voegen
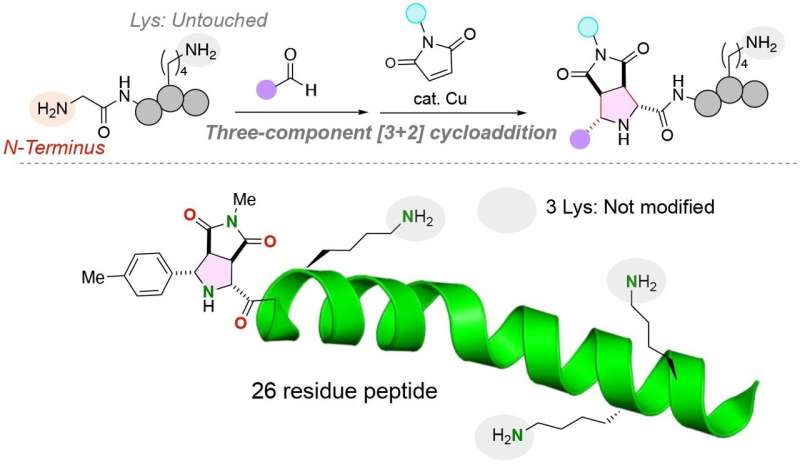
Peptiden zijn korte strengen aminozuren die steeds vaker therapeutisch worden gebruikt, als biomaterialen en als chemische en biologische probes. Het vermogen om peptiden en grotere eiwitten te isoleren, manipuleren en labelen wordt echter beperkt door het vermogen om op betrouwbare wijze functionele moleculen, zoals fluorescerende verbindingen, aan peptiden te hechten op locaties die de driedimensionale structuur en functie van de korte keten niet beïnvloeden. aminozuurstreng.