
Wetenschap
Iridium-gekatalyseerde Z-retentieve asymmetrische allylische substitutiereacties
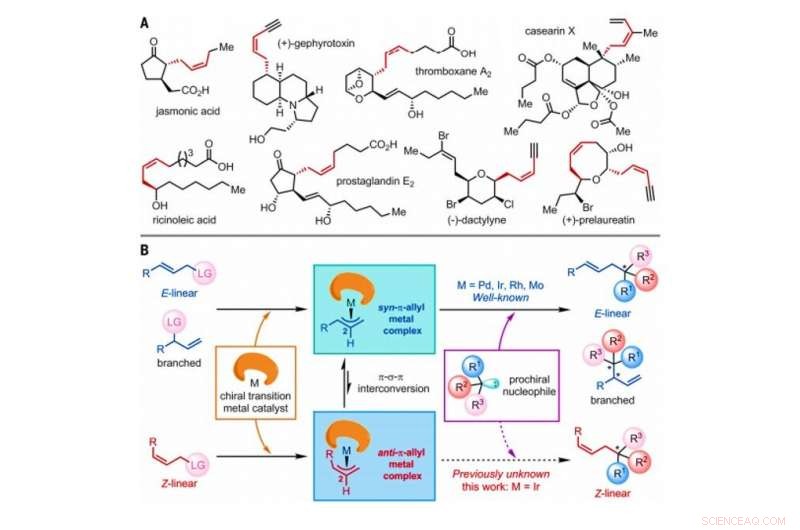
Strategie voor de constructie van Z-olefinen via asymmetrische allylische substitutiereacties gekatalyseerd door overgangsmetaalkatalysatoren. (A) geselecteerde natuurlijke producten die Z-olefinen bevatten met homoallylische stereocentra. Mij, methyl. (B) Voorgesteld algemeen mechanisme van door overgangsmetaal gekatalyseerde asymmetrische allylische substitutiereacties waarbij E-lineaire, vertakt, of Z-lineaire olefinesubstraten, die allemaal een atoom of een groep atomen bevatten die worden aangeduid als een vertrekkende groep (LG). Krediet:Wetenschap, doi:10.1126/science.abd6095
In de synthetische organische chemie, Z-olefinen zijn een uitdagend synthetisch doelwit om in het laboratorium te produceren vanwege hun relatieve thermodynamische instabiliteit. De Z-olefinen vormen een onverzadigde verbinding met een C N H 2n formule die gemakkelijk kan worden geïsomeriseerd. Analoge reacties die worden gebruikt om optisch actieve Z-olefineproducten te synthetiseren, zijn zeldzaam. In een nieuw rapport dat nu is gepubliceerd op Wetenschap , Ru Jiang en een onderzoeksteam aan de University of Chinese Academy of Sciences in Shanghai, China, gedetailleerd een door iridium gekatalyseerde asymmetrische allylische substitutiereactie om Z-olefinegeometrieën te behouden terwijl een aangrenzend quaternair stereocentrum wordt gecreëerd. Het team observeerde de vorming van tijdelijke anti-π-allyl-iridium-tussenproducten en hun opname door externe nucleofielen (elektronendonor) vóór isomerisatie om thermodynamisch stabielere syn-π-allyl-iridium-tegenhangers te vormen. De resultaten bieden een veelbelovende methode om chirale Z-olefineverbindingen in het laboratorium te bereiden.
Olefinen
Het geometrische isomeer van het Z-type van olefinen wordt algemeen gezien als basisstructuren in de natuur. Hoe dan ook, Z-olefinen zijn relatief minder stabiel in vergelijking met hun E-type tegenhangers, en daarom, het is moeilijk om ze selectief te synthetiseren in de organische chemie. Gebruikelijke methoden om toegang te krijgen tot Z-olefinen omvatten de fotogeïnduceerde isomerisatie van E-olefinen, Witting olefinering, Z-selectieve kruismetathese, Z-retentieve kruiskoppeling en de asymmetrische toevoeging van Z-allylboor-nucleofielen aan ketonen en imines. De Z-olefinen met een homoallylisch stereocentrum zijn vaak ingebed in diverse natuurlijke producten en bioactieve moleculen om aanzienlijke belangstelling voor synthetische organische chemie te genereren. Onderzoekers hebben het vermogen aangetoond om asymmetrische allylische substitutiereacties uit te voeren die worden gekatalyseerd door overgangsmetalen, waaronder molybdeen (Mo), palladium (Pd), iridium (Ir) en rhodium (Rh). Sinds het eerste rapport in 1997, Ir-gekatalyseerde asymmetrische allylische substitutiereacties hebben veel aandacht gekregen vanwege hun uitzonderlijk hoge regio- en enantioselectieve aard. In dit werk, Jiang et al. gerapporteerde reacties van Z-lineaire allylische substraten met tryptamines en tryptophol. Tijdens de uitgebreide analyse van reactiemechanismen, ze merkten de vorming van belangrijke anti-π-allyl-iridiumcomplexen op, voorafgaand aan isomerisatie om de thermodynamisch stabiele syn-π-allyl-iridium-tegenhangers te vormen.
Substraatomvang van Ir-gekatalyseerde Z-retentieve asymmetrische allylische substitutiereacties van indolderivaten. Alle reacties werden uitgevoerd volgens de hier gegeven voorwaarden, tenzij anders aangegeven. De geometrische verhouding van het Z-type tot het E-type (Z/E) en de diastereomere verhouding (dr) werden bepaald door 1H NMR-analyse van de ruwe mengsels. De geïsoleerde opbrengsten van Z-3 worden vermeld. De ee-waarden werden bepaald door high-performance vloeistofchromatografie (HPLC) analyse met een chirale stationaire fase. Asterisk geeft een Z/E-verhouding van 7:1 aan. Het enkele dolksymbool geeft een Z/E-verhouding van 8:1 aan. Het dubbele dolksymbool geeft aan dat de reacties gedurende 1 dag werden uitgevoerd. Sectiesymbool geeft een Z/E-verhouding van 11:1 aan. Paragraafsymbool geeft aan dat de reacties werden uitgevoerd met (Z)-non-2-en-1-ylacetaat, [Ir(CZV)Cl]2 (3 mol %), (S)-L1 (6 mol %), InBr3 (1,0 equivalent), en tetrabutylammoniumbromide (0,5 equiv) in CHC13 bij 0°C. Het pondsymbool geeft aan dat de reacties werden uitgevoerd met behulp van de overeenkomstige Z-allylische acetaten, [Ir(CZV)Cl]2 (4,5 mol %), (S)-L2 (9 mol %), In(OTf)3 (0,5 equiv voor Z-3aS en Z-3aT; 1 equiv voor Z-3aU) in CHCl3 bij -10°C gedurende 2 dagen. miljard, benzyl; boe, butyl; en, ethyl; Mevrouw, mesyl; Ph, fenyl; PMB, para-methoxybenzyl; p-Tol, para-tolyl; Ts, tosyl. Krediet:Wetenschap, doi:10.1126/science.abd6095 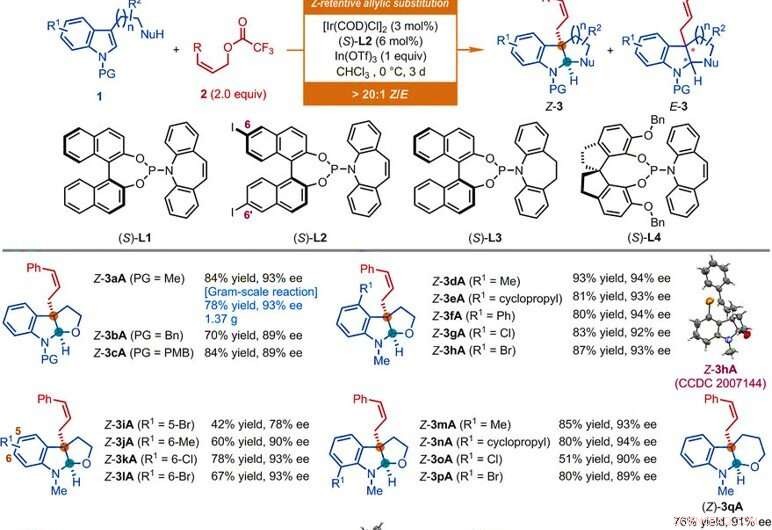
De onderzoekers onderzochten eerst de asymmetrische allylische dearomatiseringsreactie met nucleofielen zoals N-methyltryptophol met Z-cinnamylderivaten. Door Z-cinnamylacetaat te gebruiken, ze bereikten de gewenste reactie met een katalysator afgeleid van iridium cyclooctadieen (COD) chloordimeer in aanwezigheid van andere synthetische verbindingen. De wetenschappers verkregen het doelproduct met een matige opbrengst en enantioselectiviteit met een geometrische verhouding van het Z-type tot E-type van 2:1. Vervolgens optimaliseerden ze de bestanddelen om de kwaliteit en opbrengst van de synthetische producten te verbeteren. Op basis van de voorgestelde Z-retentieve asymmetrische allylische substitutiereactie, Jiang et al. verkregen diverse functionele groepscompatibiliteit die een breed substraatbereik tolereerde. Het team synthetiseerde met succes meer dan 50 voorbeelden van (homo)tryptopholen, tryptamines en indoolsubstraten met een hangende op koolstof gebaseerde nucleofiel met behulp van Z-cinnamyl-derivaten. Bijna alle reacties leverden een opbrengst op van Z-type tot E-type verhoudingen van meer dan 20:1. Voorbeelden zijn de overeenkomstige Z-cinnamylated furoindolines (afgekort Z-3aA tot Z-3pA), tetrahydropyranindoline (afgekort Z-3qA), pyrroloindolines (afgekort Z-3a'A tot Z-3o'A) en hexahydrocyclopentaindolen (afgekort Z-3a′′A tot Z-3c′′A) met goede opbrengsten tot 94 procent. Over het algemeen, de substitutie van gevarieerde elektronische en sterische eigenschappen op beschikbare posities van de indolring had geen nadelige invloed op de efficiëntie of enantioselectiviteit van de reactie. De onderzoekers stelden de structuren en absolute configuratie van de producten vast met behulp van röntgenkristallografische analyse. Vervolgens onderzochten ze ook de prestaties van de D- en L-tryptofaanderivaten.
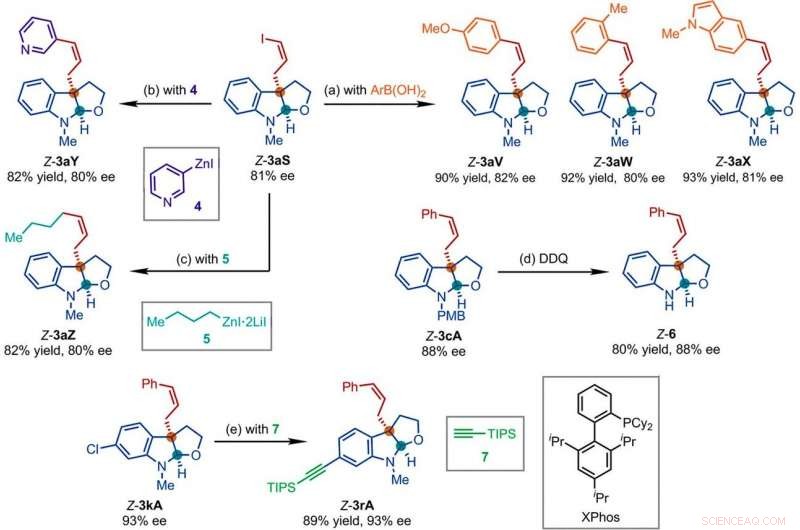
Representatieve producten verkregen in daaropvolgende reacties met de producten van Ir-gekatalyseerde Z-retentieve asymmetrische allylische substitutiereactie. Reactieomstandigheden:(a) Pd(PPh3)4 (0,5 mol %), Cs2CO3 (2 equiv), ArB(OH)2 (1,5 equiv), acetonitril, 50°C; (b) 4 (2 equivalenten), THF/diglyme (1:1), 110°C, 24 uur; (c) 5 (2 equivalenten), LiCl (4 equiv), tolueen/THF/TMU, 110°C, 24 uur; (d) DDQ (1,5 equiv), CH2Cl2, NaH2P04 (waterig 1 M); (e) 7 (2 equivalenten), PdCl2(CH3CN)2 (5 mol %), XPhos (15 mol %), Cs2CO3 (2,5 equiv), acetonitril, 80°C. aar, aryl; THF, tetrahydrofuran; TIPS, triisopropylsilyl; TMU, 1, 1, 3, 3-tetramethylureum. Krediet:Wetenschap, doi:10.1126/science.abd6095
Stroomafwaartse transformaties
De onderzoekers bestudeerden vervolgens hoe een aantal producten van de Z-retentieve asymmetrische allylische substitutiereactie gemakkelijk konden worden onderzocht in diverse stroomafwaartse transformaties. Bijvoorbeeld, het Z-vinyljodide van chirale furoindolines (afgekort Z-3aS) was reactief ten opzichte van arylboorzuren en organozinkreagentia. This provided an alternative route to produce representative products with Ir-catalyzed, Z-retentive asymmetric allylic substitution reactions with high yields of up to 82 to 93%. The scientists evaluated the proposed Z-retentive asymmetric allylic substitution reactions by a series of analyses. They obtained the Z-cinnamylated furoindolines (Z-3aA) product with optimal results in the presence of iridium atoms in the catalyst in a molar ratio of 1:1. They then characterized the key intermediates in the catalytic cycle and elucidated their structures using nuclear magnetic resonance (NMR) spectroscopy alongside X-ray crystallographic analysis. The team also monitored the reactions using electrospray ionization mass spectrometry and mechanistic studies. These results showed the isomerization of the complex from an anti- to the syn-π-allyl-iridium complex. Collectively, the analyses showed how the proposed Z-retentive asymmetric allylic substitution reaction successfully originated from the rapid and enantioselective capture of the transient anti-π-allyl-iridium complex by external nucleophiles, before converting it to more thermodynamically stable species.
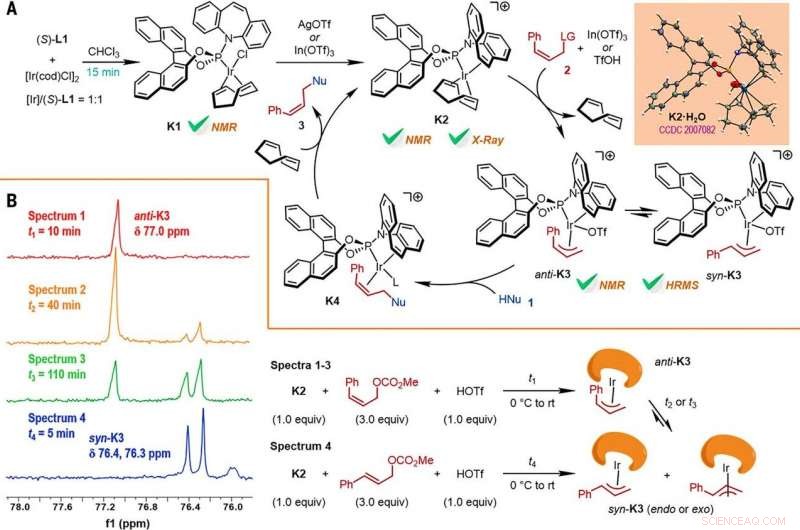
Reaction mechanism studies. (A) A proposed catalytic cycle. The key intermediates K1 and K2 were characterized by NMR spectroscopy, while K2•H2O was characterized by x-ray crystallographic analysis. HRMS, high-resolution mass spectrometry. (B) The reactions of K2 with Z- or E-cinnamyl methyl carbonate demonstrated isomerization from anti-K3 to syn-K3 according to the results of monitoring by electrospray ionization mass spectrometry (ESI-MS) and 31P NMR spectroscopy, the results of which are shown at left, with the details given by the reaction process diagrams to the right. Krediet:Wetenschap, doi:10.1126/science.abd6095
Exploring the synthetic spectrum
The scientists also explored the extension of this iridium-catalyzed Z-retentive asymmetric allylic substitution reaction to other nucleophiles. Aside from the iridium catalysts containing Carreira-type chiral ligands that function under acidic conditions, they explored Ir catalysts derived from a Feringa-type chiral phosphoramidite ligand applied under basic conditions for this reaction mode. Als resultaat, Jiang et al. used diverse nucleophiles beyond tryptophols and tryptamines. Op dit moment, they formed the prochiral nucleophiles from a copper (Cu) source. The independently prepared chiral cyclometallated Ir complex promoted the development of the transient anti-π-allyl-iridium complexes as well as their regio- and enantio-selective captures. The broad scope of the reaction presented more than 30 synthetic samples in good yields with excellent enantioselectivity. The scientists investigated the structure and absolute configuration of the products using X-ray crystallographic analyses. When the team used Z-cinnamyl acetate, they obtained a mixture of the desired Z-cinnamylated product and its branched isomer. The results highlighted the possibility of using the proposed protocol to accommodate diverse prochiral nucleophiles in asymmetric allylic substitution reactions. The researchers expect the work to evolve into a broadly practical method to synthesize chiral Z-olefins in the lab.
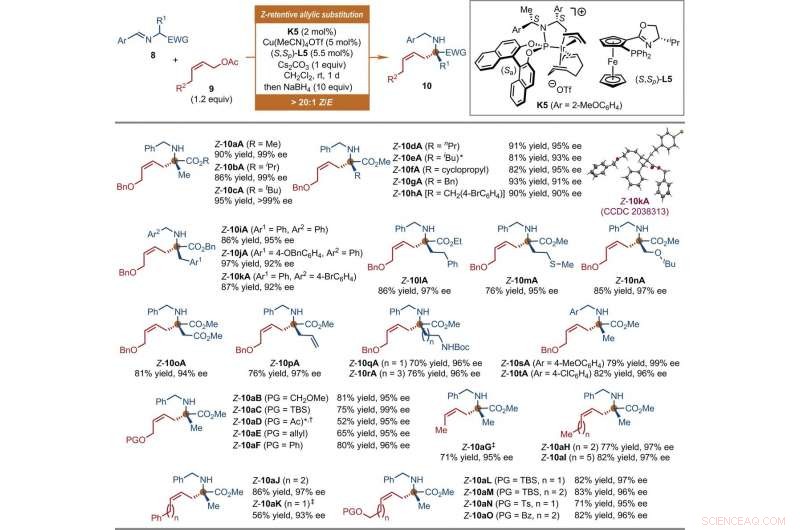
Substrate scope of Ir-catalyzed Z-retentive asymmetric allylic substitution reactions of a-amino acid derivatives. All reactions were conducted under the following conditions. Step 1:8 (0.2 mmol, 1 equiv), 9 (1.2 equiv), K5 (2 mol %), Cu(MeCN)4OTf (5 mol %), (S, Sp)-L5 (5.5 mol %), and Cs2CO3 (1 equiv) in CH2Cl2 (2 ml) at room temperature. Step 2:Reaction residue of step 1, NaBH4 (10 equiv) in CH2Cl2/MeOH (1:1, 4 ml) at room temperature. The Z-type to E-type geometric ratio (Z/E) values were determined by 1 H NMR analysis of the crude mixtures of step 1. The isolated yields of linear Z-10 are reported. The ee values were determined by HPLC analysis with a chiral stationary phase. The asterisk indicates that 9 (1.5 equiv) and K5 (4 mol %) were used. The single-dagger symbol indicates a Z/E ratio of 5.3:1. The double-dagger symbol indicates that 9 (2 equiv) was used. Ac, acetyl; Boc, tert-butoxycarbonyl; Bz, benzoyl; EWG, electron-withdrawing group; PG, protecting group; Pr, propyl; TBS, tert-butyldimethylsilyl. Krediet:Wetenschap, doi:10.1126/science.abd6095
© 2021 Science X Network
 Kleine micro-aardbevingen maken grondwater zuur
Kleine micro-aardbevingen maken grondwater zuur Marriott-hotels dumpen kleine plastic toiletflessen
Marriott-hotels dumpen kleine plastic toiletflessen Zwitserse autoriteiten waarschuwen voor instorting gletsjer gebied evacueren
Zwitserse autoriteiten waarschuwen voor instorting gletsjer gebied evacueren MABI-instrument kan de concentratie en bron van zwarte koolstofvervuiling in de atmosfeer bepalen
MABI-instrument kan de concentratie en bron van zwarte koolstofvervuiling in de atmosfeer bepalen Dromen van Comoren olie-boom hangen op seismisch onderzoek
Dromen van Comoren olie-boom hangen op seismisch onderzoek
Hoofdlijnen
- Gedurende welk deel van de interfase worden de centromeren gerepliceerd?
- Hoe maak je een geweldige flessenraket ontworpen voor afstand
- Groep:Orang-oetanwezen een teken van vernietiging van hun leefgebied
- Wat doen de Centrioles tijdens de interfase?
Centriolen vormen het microtubulekelet van de cel tijdens de interfase en dupliceren tijdens de S-fase van de interfase, samen met het DNA. Interphase bestaat uit de G1-, S- en G2-fasen. Centriolen komen
- Hebben hersencellen een lipide-dubbellaag?
- Onderzoekers laten zien hoe voedselkeuze voor insecten kan worden gemanipuleerd
- Waar ontwikkelt een Zygote in planten zich in?
- Nieuwe vissoorten vertonen opvallend kleurverschil tussen mannetjes en vrouwtjes
- Waarom bevatten de testen veel glad ER?
- Efficiënte synthese van ginkgo-verbinding kan leiden tot nieuwe medicijnen, groene insecticiden

- Onderzoekers rapporteren snelste zuivering van astatine-211 die nodig is voor gerichte kankertherapie
- Voor schonere lucht, water, en aarde

- Wetenschappers vinden groene schat - zij het roestig - in de bodem

- Een vereenvoudigde methode om olijfolie te categoriseren

 Hoe som en verschillen met breuken te schatten
Hoe som en verschillen met breuken te schatten Natuurkundigen beloven een koperrevolutie in nanofotonica
Natuurkundigen beloven een koperrevolutie in nanofotonica De ongelooflijke uitdaging om zware ladingen op Mars te landen
De ongelooflijke uitdaging om zware ladingen op Mars te landen Nieuwe biosensor kan voedsel verbeteren, waterveiligheid en kankerdetectie
Nieuwe biosensor kan voedsel verbeteren, waterveiligheid en kankerdetectie Astrofysici bestuderen verjongende pulsar in een naburig sterrenstelsel
Astrofysici bestuderen verjongende pulsar in een naburig sterrenstelsel Een sub-woestijn savanne verspreid over Madrid 14 miljoen jaar geleden
Een sub-woestijn savanne verspreid over Madrid 14 miljoen jaar geleden Verbrande gebouwen onthullen plundering van oude Turkse stad 3, 500 jaar geleden
Verbrande gebouwen onthullen plundering van oude Turkse stad 3, 500 jaar geleden Bio-geïnspireerde nano-cocons bieden gerichte medicijnafgifte tegen kankercellen
Bio-geïnspireerde nano-cocons bieden gerichte medicijnafgifte tegen kankercellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

