
Wetenschap
Team ontwikkelt peptide dat resistente bacteriën weer gevoelig maakt voor antibiotica
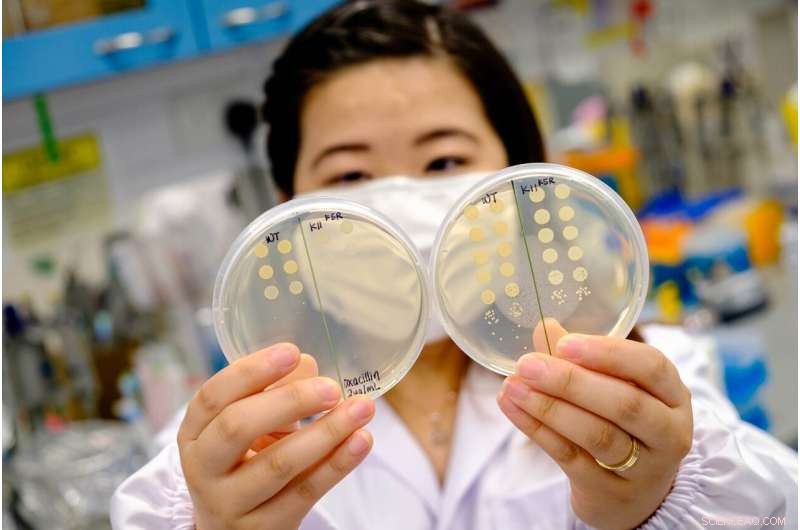
De verbeterde potentie van het antimicrobiële peptide bij gebruik met antibiotica biedt hoop op het vooruitzicht van een combinatiebehandelingsstrategie om bepaalde antibioticatolerante infecties aan te pakken. Krediet:NTU Singapore
Wetenschappers aan de Nanyang Technological University, Singapore (NTU Singapore) heeft een synthetisch peptide ontwikkeld dat multiresistente bacteriën weer gevoelig kan maken voor antibiotica bij gebruik in combinatie met traditionele antibiotica. hoop bieden op een combinatiebehandelingsstrategie om bepaalde antibioticatolerante infecties aan te pakken.
Op zichzelf, het synthetische antimicrobiële peptide kan ook bacteriën doden die resistent zijn geworden tegen antibiotica.
Elk jaar, naar schatting 700, Wereldwijd sterven 000 mensen aan antibioticaresistente ziekten, volgens de Wereldgezondheidsorganisatie. Bij gebrek aan nieuwe therapieën, infecties veroorzaakt door resistente superbacteriën kunnen tegen 2050 wereldwijd elk jaar 10 miljoen extra doden, kanker overtreffen. Antibioticaresistentie ontstaat bij bacteriën wanneer ze medicijnen kunnen herkennen en voorkomen die hen anders zouden doden, van hun celwand passeren.
Deze dreiging wordt versneld door de zich ontwikkelende COVID-19-pandemie, met patiënten die zijn opgenomen in ziekenhuizen die vaak antibiotica krijgen om secundaire bacteriële infecties onder controle te houden, het vergroten van de kans voor resistente ziekteverwekkers om op te duiken en zich te verspreiden.
Het NTU Singapore-team, onder leiding van universitair hoofddocent Kimberly Kline en professor Mary Chan, een antimicrobieel peptide ontwikkeld dat bekend staat als CSM5-K5, bestaande uit herhaalde eenheden chitosan, een suiker gevonden in schaaldieren die structurele gelijkenis vertoont met de bacteriële celwand, en herhaalde eenheden van het aminozuur lysine.
De wetenschappers geloven dat de structurele gelijkenis van chitosan met de bacteriële celwand het peptide helpt om te interageren met en zich erin in te bedden, veroorzaakt defecten in de wand en het membraan die uiteindelijk de bacteriën doden.
Het team testte het peptide op biofilms, dit zijn slijmerige lagen bacteriën die zich kunnen hechten aan oppervlakken zoals levende weefsels of medische hulpmiddelen in ziekenhuizen, en die voor traditionele antibiotica moeilijk te penetreren zijn.
In zowel voorgevormde biofilms in het lab als biofilms gevormd op wonden bij muizen, het door NTU ontwikkelde peptide doodde ten minste 90 procent van de bacteriestammen in vier tot vijf uur.
In afzonderlijke experimenten, wanneer CSM5-K5 werd gebruikt met antibiotica waar de bacteriën anders resistent voor zijn, meer bacteriën werden gedood in vergelijking met wanneer CSM5-K5 alleen werd gebruikt, wat suggereert dat het peptide de bacteriën vatbaar maakte voor antibiotica. De hoeveelheid antibiotica die bij deze combinatietherapie werd gebruikt, was ook in een lagere concentratie dan gewoonlijk wordt voorgeschreven.
De bevindingen zijn gepubliceerd in het wetenschappelijke tijdschrift ACS Infectieziekten in mei.
Assoc prof. Kimberly Kline, een hoofdonderzoeker bij het Singapore Centre for Environmental Life Sciences Engineering (SCELSE) bij NTU, zei:"Onze bevindingen tonen aan dat ons antimicrobiële peptide effectief is, of het nu alleen of in combinatie met conventionele antibiotica wordt gebruikt om multiresistente bacteriën te bestrijden. Zijn potentie neemt toe bij gebruik met antibiotica, de gevoeligheid van de bacterie voor medicijnen weer herstellen. Belangrijker, we ontdekten dat de bacteriën die we testten weinig tot geen resistentie ontwikkelden tegen ons peptide, waardoor het een effectieve en haalbare aanvulling op antibiotica is als een haalbare combinatiebehandelingsstrategie terwijl de wereld worstelt met toenemende antibioticaresistentie."
Prof Mary Chan, directeur van NTU's Center of Antimicrobial Bioengineering, zei:"Hoewel de inspanningen zijn gericht op het omgaan met de COVID-19-pandemie, we mogen ook niet vergeten dat antibioticaresistentie een groeiend probleem blijft, waar secundaire bacteriële infecties die zich bij patiënten ontwikkelen de zaken kunnen compliceren, een bedreiging vormen in de zorginstellingen. Bijvoorbeeld, virale luchtweginfecties kunnen ervoor zorgen dat bacteriën gemakkelijker de longen kunnen binnendringen, leidend tot bacteriële longontsteking, die vaak wordt geassocieerd met COVID-19."
Hoe het antimicrobiële peptide werkt
Antimicrobiële peptiden, die een positieve elektrische lading dragen, werken meestal door zich te binden aan de negatief geladen bacteriële membranen, het membraan verstoren en ervoor zorgen dat de bacteriën uiteindelijk sterven. Hoe positiever een peptide is geladen, hoe efficiënter het is in het binden aan bacteriën en dus doden.
Echter, de toxiciteit van het peptide voor de gastheer neemt ook toe in lijn met de positieve lading van het peptide - het beschadigt de cellen van het gastheerorganisme omdat het bacteriën doodt. Als resultaat, gemanipuleerde antimicrobiële peptiden hebben tot op heden beperkt succes gehad, zei Assoc Prof Kline, die ook van de NTU School of Biological Sciences is.
Het peptide ontworpen door het NTU-team, genaamd CSM5-K5, is in staat om samen te clusteren om nanodeeltjes te vormen wanneer het wordt toegepast op biofilms van bacteriën. Deze clustering resulteert in een meer geconcentreerd verstorend effect op de bacteriële celwand in vergelijking met de activiteit van enkele ketens van peptiden, wat betekent dat het een hoge antibacteriële activiteit heeft, maar zonder onnodige schade aan gezonde cellen te veroorzaken.
Om de werkzaamheid van CSM5-K5 op zichzelf te onderzoeken, de NTU-wetenschappers ontwikkelden afzonderlijke biofilms bestaande uit methicilline-resistente Staphylococcus aureus, algemeen bekend als de MRSA-superbug; een zeer virulente multiresistente stam van Escherichia coli (MDR E. Coli); en vancomycine-resistente Enterococcus faecalis (VRE). MRSA en VRE worden door de Amerikaanse Centers for Disease Control and Prevention geclassificeerd als ernstige bedreigingen.
Bij laboratoriumexperimenten, CSM5-K5 doodde meer dan 99 procent van de biofilmbacteriën na vier uur behandeling. In geïnfecteerde wonden bij muizen, het door NTU ontwikkelde antimicrobiële peptide doodde meer dan 90 procent van de bacteriën.
Wanneer CSM5-K5 werd gebruikt met conventionele antibiotica, het NTU-team ontdekte dat de combinatiebenadering leidde tot een verdere vermindering van de bacteriën in zowel laboratoriumgevormde biofilms als geïnfecteerde wonden bij muizen in vergelijking met wanneer alleen CSM5-K5 werd gebruikt, wat suggereert dat het antimicrobiële peptide de bacteriën gevoelig maakte voor de medicijnen waartegen ze anders resistent zouden zijn.
Belangrijker, ontdekte het NTU-team dat de drie bestudeerde bacteriestammen (MRSA, VRE en MDR E. coli) ontwikkelden weinig tot geen resistentie tegen CSM5-K5. Terwijl MRSA een lage resistentie ontwikkelde tegen CSM5-K5, dit maakte MRSA gevoeliger voor het medicijn waartegen het anders resistent is.
Prof Chan zei:"Het ontwikkelen van nieuwe medicijnen alleen is niet langer voldoende om moeilijk te behandelen bacteriële infecties te bestrijden. naarmate bacteriën blijven evolueren en antibiotica te slim af zijn/ Het is belangrijk om te kijken naar innovatieve manieren om moeilijk te behandelen bacteriële infecties aan te pakken die verband houden met antibioticaresistentie en biofilms, zoals het aanpakken van de afweermechanismen van de bacterie. Een effectievere en economischere methode om bacteriën te bestrijden is door middel van een combinatietherapie zoals de onze."
De volgende stap voorwaarts voor het team is om te onderzoeken hoe een dergelijke combinatietherapiebenadering kan worden gebruikt voor zeldzame ziekten of voor wondverzorging.
 Lang gezochte structuur van telomerase effent de weg voor nieuwe geneesmiddelen voor veroudering, kanker
Lang gezochte structuur van telomerase effent de weg voor nieuwe geneesmiddelen voor veroudering, kanker Nieuwe manier om ecstasy te detecteren ontdekt
Nieuwe manier om ecstasy te detecteren ontdekt Onderzoeker creëert chemisch systeem dat vroeg celgedrag nabootst
Onderzoeker creëert chemisch systeem dat vroeg celgedrag nabootst Xenon verbetert de eigenschappen van maxillofaciale en orthopedische implantaten
Xenon verbetert de eigenschappen van maxillofaciale en orthopedische implantaten Olievangende spons kan resten van offshore-boringen opzuigen
Olievangende spons kan resten van offshore-boringen opzuigen
 Katoenoogst schiet omhoog in Ivoorkust
Katoenoogst schiet omhoog in Ivoorkust Extreem winterweer, zoals Beest uit het Oosten, kan worden gekoppeld aan zonnecyclus
Extreem winterweer, zoals Beest uit het Oosten, kan worden gekoppeld aan zonnecyclus Winterbanden met noppen kosten meer levens dan ze besparen, bijdragen aan een wereldwijd conflict
Winterbanden met noppen kosten meer levens dan ze besparen, bijdragen aan een wereldwijd conflict Kritisch denken gebruiken om valse klimaatclaims te herkennen
Kritisch denken gebruiken om valse klimaatclaims te herkennen Seismologen bezorgd over bevingen in DR Congo
Seismologen bezorgd over bevingen in DR Congo
Hoofdlijnen
- De kenmerken van de mitochondria
- Een eerste blik op geografische variatie in ezelspinguïnoproepen
- Welke organel moet aanwezig zijn in grote aantallen in spiercellen?
- Your Body On: A Horror Movie
- Wel of niet fokken? Trekkende vrouwelijke vlinders staan voor een moessondilemma
- Dieetbeperking en levensduur bij mannelijke en hermafrodiete wormen
- Herstel van iconische inheemse vogel veroorzaakt problemen in stedelijke gebieden
- Nutrient Agar vs. Blood Agar
- Genetische modificatie: definitie, soorten, proces, voorbeelden
- Een theoretische studie verklaart de natuurlijke selectie van eiwitten
- Enthalpieverandering berekenen

- Bio-ingenieurs ontwikkelen 3D-structuren van krabschalen om beschadigde weefsels te vervangen

- Chemici bepalen hoe bijproducten bij de synthese van perovskieten kunnen worden vermeden
- Nieuwe techniek voor het bestuderen van roesten van staal komt de mijnbouwsector ten goede

 Dimensies lezen
Dimensies lezen  Onderzoekers demonstreren een elektrochrome nanoplasmonische optische schakelaar
Onderzoekers demonstreren een elektrochrome nanoplasmonische optische schakelaar Onderzoekswetenschappers ontdekken nieuwe productieroute voor SOS-signalen van planten
Onderzoekswetenschappers ontdekken nieuwe productieroute voor SOS-signalen van planten Verre melkweg zendt 15 energierijke radioflitsen uit
Verre melkweg zendt 15 energierijke radioflitsen uit Hoor geluiden vastgelegd van Mars door NASA's Perseverance rover
Hoor geluiden vastgelegd van Mars door NASA's Perseverance rover Wetenschappers stellen nieuwe eigenschappen voor in holle multishell-structuur
Wetenschappers stellen nieuwe eigenschappen voor in holle multishell-structuur Grafeencoating die van kleur verandert bij vervorming of barsten
Grafeencoating die van kleur verandert bij vervorming of barsten NASA IMERG onthult regenval van tropische cycloon Berguitta
NASA IMERG onthult regenval van tropische cycloon Berguitta
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

