
Wetenschap
Studie:structuur van biokatalysatoren hangt af van of ze zich in cellen of in de reageerbuis bevinden
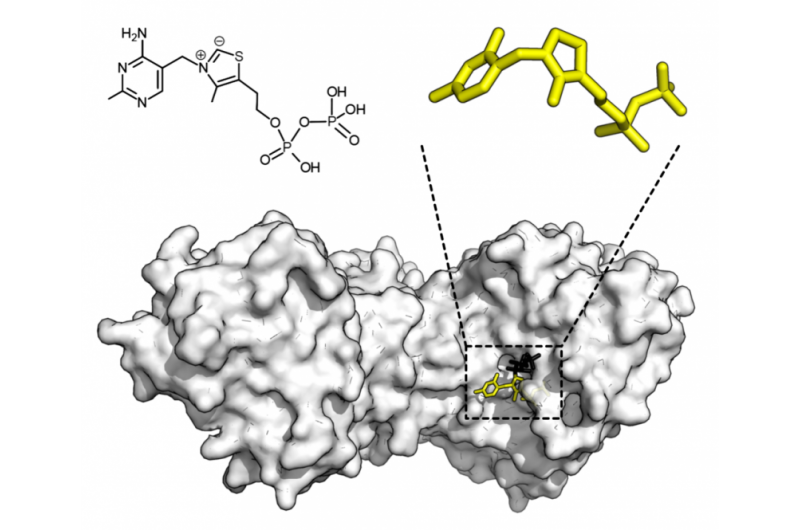
Chemische structuur voor thiaminepyrofosfaat en eiwitstructuur van transketolase. Thiamine pyrofosfaat cofactor in geel en xylulose 5-fosfaat substraat in zwart. Krediet:Thomas Shafee/Wikipedia
De structuur van enzymen bepaalt hoe ze vitale processen zoals de spijsvertering of immuunrespons aansturen. Dit komt omdat de eiwitverbindingen niet rigide zijn, maar kunnen hun vorm veranderen door beweegbare "scharnieren". De vorm van enzymen kan afhangen van het feit of hun structuur wordt gemeten in de reageerbuis of in de levende cel. Dit ontdekten natuurkundigen van de Universiteit van Bonn over YopO, een enzym van de pestpathogeen. Dit fundamentele resultaat, die nu is gepubliceerd in het tijdschrift Angewandte Chemie , is mogelijk ook interessant voor geneesmiddelenonderzoek.
Alle levende cellen bevatten eiwitten, die essentieel zijn voor het behoud van lichaamsfuncties. Eiwitten bestaan voornamelijk uit aminozuren en, als katalysatoren (enzymen), biochemische reacties mogelijk maken die anders niet zouden plaatsvinden. Enzymen regelen bijvoorbeeld de spijsvertering en het immuunsysteem. "Het type biochemische reacties en hoe ze plaatsvinden, hangt af van de structuur van de eiwitten, " zegt Prof. Dr. Olav Schiemann van het Instituut voor Fysische en Theoretische Chemie aan de Universiteit van Bonn. Eiwitten zijn niet rigide, maar kunnen hun vorm veranderen door beweegbare "scharnieren". Dit samenspel tussen structuur en dynamiek bepaalt wat er gebeurt. Het enzym en de te transformeren stof moeten als een sleutel en slot in elkaar passen om een specifiek proces te katalyseren.
YopO is verankerd in het membraan en daardoor bijzonder stabiel
De wetenschappers gebruikten voor hun onderzoek een eiwit van pestpathogenen (Yersinia). Deze bedriegen het immuunsysteem door eiwitten zoals YopO (Yersinia buitenste proteïne O) in de aanvallende macrofagen te injecteren. YopO bindt aan de actine van de verdedigende cellen, waardoor de immuuncellen de ziekteverwekkers niet langer kunnen omhullen en verteren. "We hebben YopO gebruikt omdat dit enzym medisch interessant is en kan worden verankerd of geïmmobiliseerd in een membraan, " legt Schiemann uit. "Dat laatste is een belangrijke voorwaarde voor onze metingen bij kamertemperatuur."
Nico Fleck van de onderzoeksgroep van Schiemann ontwikkelde hiervoor spinlabels die specifiek zijn aangepast voor onderzoek in de cel. Dit zijn kleine "vlaggen" die teamlid Caspar A. Heubach op verschillende posities van het eiwit bevestigde. Met behulp van de DQC-methode (Double Quantum Coherence), die werkt als een liniaal op moleculair niveau, teamlid Tobias Hett mat vervolgens de afstanden tussen de vlaggen. "Als we de afstanden tussen de spinlabels kennen, kunnen we afleiden welke structuren een bepaald enzym kan aannemen, " zegt Hett. Dit werkt een beetje als een "navigatiesysteem" voor moleculen; ook het geleidingssysteem voor voertuigen is gebaseerd op afstandsmetingen.
De onderzoekers pasten de DQC-methode toe op YopO in de reageerbuis en, ter vergelijking, in eieren van de Afrikaanse klauwkikker, die vaak worden gebruikt als modelorganismen in de wetenschap. Voor de metingen in de cel, de YopO getagd met de vlaggen werd met een injectiespuit in de eieren gespoten, "zeer vergelijkbaar met de manier waarop de plaagpathogenen op moleculair niveau doen, " legt Nico Fleck uit. Hieruit bleek dat YopO in een waterige oplossing in de reageerbuis een groter aantal verschillende structuren kon opnemen dan in de eieren. "YopO is structureel mobieler in de reageerbuis dan in levende cellen, " zegt Schiemann. "In cellen, structuren zoals membranen en interacties met andere eiwitten verminderen de structurele diversiteit van YopO."
Fundamenteel principe
Deze bevinding geldt niet alleen voor YopO, maar is een fundamenteel principe:in de reageerbuis is er geen "korset" opgelegd door andere celstructuren, de ontvouwingsmogelijkheden voor enzymen zijn groter. Dat heeft volgens de onderzoekers gevolgen voor alle onderzoeken met biomoleculen. “Onderzoeken van de geïsoleerde biomoleculen zijn zeker essentieel. Voor een compleet beeld, echter, dergelijke structuren en dynamiek moeten onder zo natuurlijk mogelijke omstandigheden worden bestudeerd, ", zegt Schiemann. Caspar Heubach voegt toe:"Als de resultaten van een onderzoek verwijzen naar biomoleculaire processen in cellen, men zou, zoals in dit geval, onderzoek ook de structuur en dynamiek van eiwitten in levende cellen."
Omdat eiwitten verschillende cellulaire processen aansturen, ze zijn ook de focus van de zoektocht naar nieuwe behandelingen. De onderzoekers zijn er dan ook van overtuigd dat de resultaten gepresenteerd door het onderzoeksteam van de Universiteit van Bonn ook van potentieel belang zijn voor farmaceutisch onderzoek. "De interacties in de cel zijn belangrijk voor de structuur en dynamiek van eiwitten, ", zegt Schiemann. "Het maakt dus verschil hoe de structuur van enzymen wordt bepaald bij het zoeken naar werkzame stoffen."
 Wetenschappers vinden milieuvriendelijke manier om spijkerbroeken te verven
Wetenschappers vinden milieuvriendelijke manier om spijkerbroeken te verven Bierafval scheiden in eiwitten voor voedingsmiddelen, en vezels voor biobrandstoffen
Bierafval scheiden in eiwitten voor voedingsmiddelen, en vezels voor biobrandstoffen Nieuwe methode zet koolstofdioxide om in methaan bij lage temperaturen
Nieuwe methode zet koolstofdioxide om in methaan bij lage temperaturen Beschrijf de vier kwantumgetallen die worden gebruikt om een elektron in een atoom te karakteriseren
Beschrijf de vier kwantumgetallen die worden gebruikt om een elektron in een atoom te karakteriseren  Welke broodvormen sneller zijn?
Welke broodvormen sneller zijn?
 Digitale technologie:vriend of vijand tegen klimaatverandering?
Digitale technologie:vriend of vijand tegen klimaatverandering? Angstaanjagende inzichten in klimaatverandering kunnen een wetgevend momentum creëren voor emissiereducties, onderzoekers beweren:
Angstaanjagende inzichten in klimaatverandering kunnen een wetgevend momentum creëren voor emissiereducties, onderzoekers beweren: Nieuwe studie toont aan dat vegetatie de toekomst van de watercyclus bepaalt
Nieuwe studie toont aan dat vegetatie de toekomst van de watercyclus bepaalt Vergeet haaien... hier is de kans groter dat je gewond raakt door zwerfvuil op het strand
Vergeet haaien... hier is de kans groter dat je gewond raakt door zwerfvuil op het strand Niet aanpassen aan klimaatverandering kost waarschijnlijk minstens vijf keer meer
Niet aanpassen aan klimaatverandering kost waarschijnlijk minstens vijf keer meer
Hoofdlijnen
- Vier potvissen sterven bij redding op strand in Indonesië
- Hoe cellen tellen met een microscoop
- Wat is perifeer bloed?
- Hoe converteert ADP naar ATP?
- Onderzoekers ontdekken hoe cellen decennia later infecties onthouden
- Nieuwe ontdekking om de ontwikkeling van zouttolerante wijnstokken te versnellen
- Waarom herinneren we ons pijn?
- Gespecialiseerde cellen: definitie, soorten en voorbeelden
- Onderzoekers creëren nieuwe letters om DNA-functies te verbeteren
- Forensische wetenschappers ontsluiten unieke chemische handtekeningen in banden

- De relatie tussen delicate hechtdraadstructuur en dempende prestaties van biomaterialen
- Vergroening van de farmaceutische industrie
- Micro-/nano-architecturen in MOF-membraan versnellen olie-waterscheiding

- Onderzoekers maken doorbraak in lichtvangtechnologie voor industriële multikristallijne siliciumzonnecellen

 Tijdelijk richten met tijdelijke metamaterialen
Tijdelijk richten met tijdelijke metamaterialen Blootstelling aan microplastics kan de cellulaire functie veranderen
Blootstelling aan microplastics kan de cellulaire functie veranderen Versterker voor terahertz-roostertrillingen in een halfgeleiderkristal
Versterker voor terahertz-roostertrillingen in een halfgeleiderkristal Onderzoekers creëren de eerste laag-energetische deeltjesversnellerstraal ondergronds in de Verenigde Staten
Onderzoekers creëren de eerste laag-energetische deeltjesversnellerstraal ondergronds in de Verenigde Staten Landbouwintensivering geen blauwdruk voor duurzame ontwikkeling
Landbouwintensivering geen blauwdruk voor duurzame ontwikkeling Aardwarmte gebruiken om je huis te koelen
Aardwarmte gebruiken om je huis te koelen Wat gebeurt er met luchtdruk met een toename van waterdamp?
Wat gebeurt er met luchtdruk met een toename van waterdamp?  Intense lasers koken complexe, zelf-geassembleerde nanomaterialen
Intense lasers koken complexe, zelf-geassembleerde nanomaterialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

