
Wetenschap
Nieuw begrip van de synthese van antibiotica
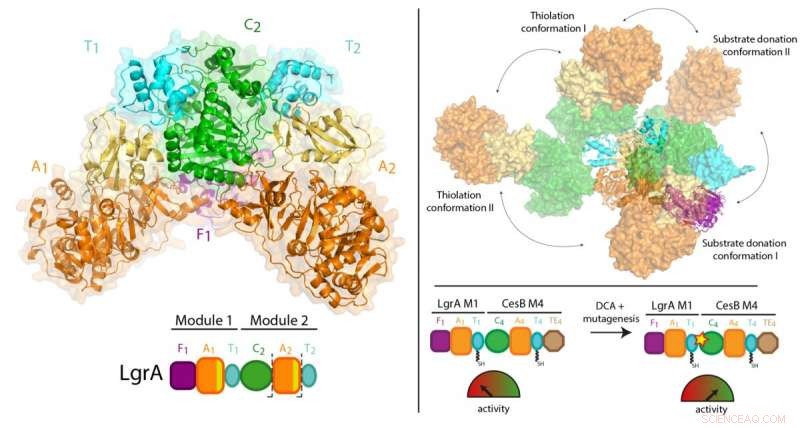
Krediet:McGill University
Onderzoekers van de geneeskundefaculteit van de McGill University hebben belangrijke vooruitgang geboekt bij het begrijpen van de werking van enzymen die een integrale rol spelen bij de productie van antibiotica en andere therapieën. Hun bevindingen zijn gepubliceerd in Wetenschap .
"Veel van de medicijnen waar we tegenwoordig op vertrouwen, zijn natuurlijke producten, gemaakt door de flora van de aarde, " legt Dr. Martin Schmeing uit, Universitair hoofddocent bij de afdeling Biochemie van McGill en senior auteur van de studie. "Dit omvat verbindingen die in microben worden gemaakt door enorme enzymen die niet-ribosomale peptidesynthetasen worden genoemd, of NRPS'en. NRPS's synthetiseren allerlei soorten antibiotica, die gevaarlijke schimmels en bacteriën kunnen doden, evenals verbindingen om ons te helpen virale infecties en kankers te bestrijden. Bijvoorbeeld, deze verbindingen omvatten viomycine, een antibioticum dat wordt gebruikt voor de behandeling van multiresistente tuberculose; ciclosporine, dat op grote schaal is gebruikt als een immunosuppressivum bij orgaantransplantaties; en het bekende antibioticum penicilline."
Om deze medicijnen te synthetiseren, NRPS's werken vergelijkbaar met een fabrieksassemblagelijn, bestaande uit een reeks werkstations. Elk station, een "module" genoemd, " heeft workflows in meerdere stappen en bewegende delen waarmee het één bouwsteencomponent aan het groeiende medicijn kan toevoegen.
De innerlijke werking van de lopende band begrijpen
Eerder werk van Dr. Schmeing en anderen heeft geleid tot een goed begrip van hoe één module werkt. Nutsvoorzieningen, met behulp van een techniek genaamd röntgenkristallografie bij de Canadese lichtbron in Saskatchewan, en de Advanced Photon Source in Illinois, het team was in staat om 3D-foto's met ultrahoge resolutie van de NRPS's te maken.
Voor de eerste keer, ze waren in staat om hoogwaardige observaties te doen over hoe een individuele module zich verhoudt tot de grotere assemblagelijn, door een deel van de NRPS's met twee modules te visualiseren dat het antibioticum lineaire gramicidine maakt (gevonden in Polysporin-behandelingen). De studie vond een verrassend gebrek aan synchronisatie tussen modules op alle punten, behalve wanneer ze moeten coördineren om het tussenproduct van het ene werkstation naar het andere door te geven. Aanvullend, ze ontdekten dat de modules niet in een rechte lijn of op een andere georganiseerde manier op één lijn liggen, maar kan in plaats daarvan in veel verschillende relatieve posities worden opgesteld. "Dit niveau van enorme flexibiliteit was niet verwacht, " merkt Dr. Schmeing op, die ook directeur is van McGill's Center for Structural Biology. "De enzymen voeren gymnastiek uit."
Omdat de eiwitten gevangen zitten in een kristal, er werd voor gezorgd dat de resultaten representatief waren voor wat er in het echte leven gebeurt. Dr. Schmeing werkte samen met zijn collega, Dr. Alba Guarné, Professor in de afdeling Biochemie van McGill, om aanvullende oplossingsgegevens te gebruiken, verzameld bij de Advanced Light Source in Berkeley om de waarnemingen te valideren. "De structurele biologiegemeenschap is erg sterk bij McGill. We werken samen om elkaar te helpen in samenwerkingen, om de biofysische apparatuur te verkrijgen die nodig is voor geavanceerde experimenten, en om onze studenten op te leiden", zegt Dr. Schmeing, opmerkend dat de experimentatoren op het papier, Janice Reimer, Max Eivaskhani en Ingrid Harb, zijn allemaal getalenteerde McGill-afgestudeerde studenten. "De omgeving en collega's van het McGill Center for Structural Biology zijn belangrijk voor het aanhoudende succes van onze laboratoria."
Toekomstige implicaties voor therapeutisch ontwerp
De resultaten kunnen op lange termijn gevolgen hebben voor de productie van nieuwe antibiotica en therapieën. Sinds ze voor het eerst werden ontdekt, wetenschappers zijn enthousiast over de mogelijkheid om NRPS's bio-engineering te geven door werkstations te mixen en matchen om designerverbindingen te produceren. "Onze studie laat zien dat het mogelijk moet zijn om deze modules te mixen en matchen, maar dat de biotechnologische NRPS's moeten worden aangepast op de punten die betrokken zijn bij het doorgeven van de verbinding van de ene module naar de volgende om ze goed te laten werken, " legt Dr. Schmeing uit. "Dit is iets dat we samen met Martin Weigt van de Sorbonne hebben gedaan als een bewijs van principe in de krant, maar die moet worden geoptimaliseerd voor de productie van designertherapieën."
"Structuren van een dimodulaire niet-ribosomale peptidesynthetase onthullen conformationele flexibiliteit, " door Reimer, J.M., Eivaskhani, M, harb, L., guarne, EEN, gewicht, M., Schmeing, T. M. werd gepubliceerd in het tijdschrift Wetenschap .
 Onderzoeksteams ontdekken buitengewone eigenschappen van strontiumniobaat
Onderzoeksteams ontdekken buitengewone eigenschappen van strontiumniobaat Computerkatalysatoren - team ontsluit de moleculaire geheimen van een populair polymeer
Computerkatalysatoren - team ontsluit de moleculaire geheimen van een populair polymeer Onderzoekers kijken in de databank van waterclusters, treinnetwerk om energielandschappen te voorspellen
Onderzoekers kijken in de databank van waterclusters, treinnetwerk om energielandschappen te voorspellen Het nabootsen van het beste medicijn van de natuur opent de deur naar nieuwe behandelingen
Het nabootsen van het beste medicijn van de natuur opent de deur naar nieuwe behandelingen Hoe het vriespunt van een mengsel te berekenen
Hoe het vriespunt van een mengsel te berekenen
 Geestelijke gezondheid kan het volgende slachtoffer zijn van de opwarming van de aarde
Geestelijke gezondheid kan het volgende slachtoffer zijn van de opwarming van de aarde Natuurlijke hulpbronnen van de Sahara-woestijn
Natuurlijke hulpbronnen van de Sahara-woestijn De nieuwe aquamarijnkleur van Mekong Rivers kan een teken van problemen zijn
De nieuwe aquamarijnkleur van Mekong Rivers kan een teken van problemen zijn Supercomputing-inspanning om de complexe interacties die van invloed zijn op klimaatverandering in Arctische kustgebieden te modelleren
Supercomputing-inspanning om de complexe interacties die van invloed zijn op klimaatverandering in Arctische kustgebieden te modelleren Hoe P. juliflora-struikwortels arseen opruimen en immobiliseren uit giftige mijnresten
Hoe P. juliflora-struikwortels arseen opruimen en immobiliseren uit giftige mijnresten
Hoofdlijnen
- Ideeën voor een Sunscreen Science Fair Project
- Nieuwe software kan binnen enkele minuten iemands identiteit verifiëren aan de hand van hun DNA
- Transcriptiefactoren en genexpressie heroverwegen
- De functies van de linker temporale kwab
- Zijn linkshandigen snellere denkers dan rechtshandigen?
- EU stemt ermee in om in 2018 meer vis op een duurzame manier te vangen
- Hoe vogelgriep werkt
- De voor- en nadelen van mutatie
- Wat is het voordeel van het gebruik van vlekken om naar cellen te kijken?
- Wetenschappers lossen een duurzaamheidsprobleem op in brandstofcellen voor waterstofauto's
- Onverwoestbaar virus onthult geheim voor het maken van ongelooflijk duurzame materialen

- Nieuwe materialen voor duurzame, goedkope batterijen

- Nieuwe techniek maakt real-time microscopie mogelijk bij hoge temperaturen en belasting

- Zeldzame aardelementen in afvalhopen in de mijnbouw

 Nanobuis-elektroden verbeteren zonnecellen, tegen lage kosten kan opleveren, efficiënt alternatief
Nanobuis-elektroden verbeteren zonnecellen, tegen lage kosten kan opleveren, efficiënt alternatief Op weg naar een goedkope industrialisatie van lithium-ioncondensatoren
Op weg naar een goedkope industrialisatie van lithium-ioncondensatoren Amorf metaalglas voor hooggevoelige MEMS-microfoons
Amorf metaalglas voor hooggevoelige MEMS-microfoons Natuurkunde Nobel voor zwarte gaten te laat voor Hawking
Natuurkunde Nobel voor zwarte gaten te laat voor Hawking Revolutionair geleidend polymeer maakt gebruik van silicium mogelijk als volgende generatie lithium-ionbatterijanodes
Revolutionair geleidend polymeer maakt gebruik van silicium mogelijk als volgende generatie lithium-ionbatterijanodes Hoe Nepal profiteert als vrouwen actief worden in waterbeheer
Hoe Nepal profiteert als vrouwen actief worden in waterbeheer Softwaregigant SAP sluit kantoren in India na angst voor varkensgriep
Softwaregigant SAP sluit kantoren in India na angst voor varkensgriep Next-gen donkere materie detector in een race om de finish te halen
Next-gen donkere materie detector in een race om de finish te halen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

