
Wetenschap
Doorbraak werpt licht op ziektebestrijdende eiwitten
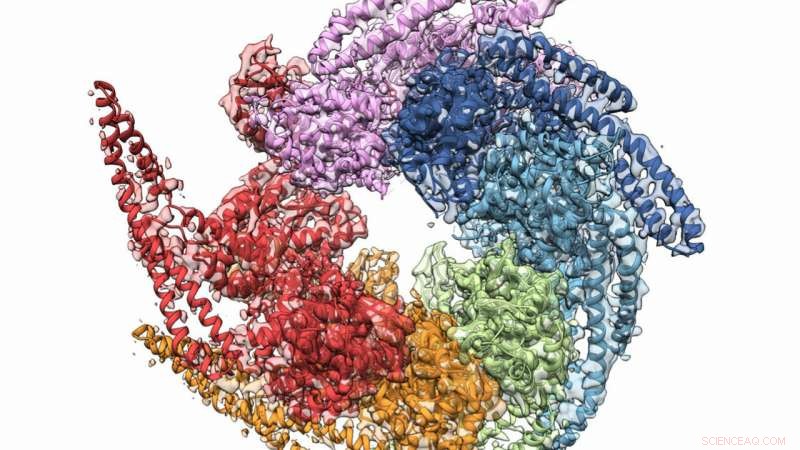
De gecombineerde kristal- en cryo-elektronenmicroscopiestructuren van Hsp104 vallen uiteen van de schimmel Calcarisporiella thermophila . Krediet:Grigore Pintilie / Stanford University
Röntgen- en elektronenmicroscopietechnieken helpen het verhaal van eiwitchaperonnes te ontrafelen.
Een combinatie van röntgenkristallografie en cryo-elektronenmicroscopie (cryo-EM) hielp bij een gezamenlijke inspanning om de structuur met de hoogste resolutie van het schimmeleiwit Hsp104 te verkrijgen, die kunnen dienen om de vorming van bepaalde degeneratieve ziekten te belemmeren. Het team, met als leden onderzoekers van het Argonne National Laboratory van het Amerikaanse Department of Energy (DOE), verifieerde ook een spiraalvormige structuur voor de eiwitgevormde hexameren, ooit geloofde plat. De resultaten werden online gepubliceerd op 27 december, 2018-uitgave van Structuur .
Hsp104 is een hexameer AAA+-eiwit dat bekend staat als een chaperonne, die helpt bij de natuurlijke vouwprocessen van eiwitten voor een goede celfunctie. Belangrijker, misschien, deze klasse van hexameren kan verkeerd gevouwen of geaggregeerde eiwitten repareren die kunnen leiden tot door eiwitten veroorzaakte afwijkingen zoals neurodegeneratie.
Varianten van deze chaperonnes komen veel voor bij meercellige organismen, maar Hsp104 heeft geen homoloog tussen mensen en andere dieren. Hoewel het robuuster is dan van mensen afgeleide chaperonnes die kunnen falen onder cellulaire stress, Er is waargenomen dat Hsp104 menselijke eiwitten vouwt.
"We hebben wat experimenten gedaan waarbij we menselijke eiwitten tot expressie brachten in gist, wat de gist ziek maakt omdat ze samenklonteren. Maar als je Hsp104 uitdrukt, die van de schimmel Calcarisporiella thermophila , het beschermt de gist tegen deze aggregatieziekte, " zei Argonne Distinguished Fellow Andrzej Joachimiak.
Joachimiak werkte met een team bestaande uit onderzoekers uit Argonne, de Universiteit van Chicago, Stanford University en de University of Pennsylvania om de structuur en functie van Hsp104 beter te begrijpen.
Het team wendde zich tot Argonne's Advanced Photon Source, een DOE Office of Science gebruikersfaciliteit, om de structuur van het eiwit te onderzoeken met behulp van röntgenkristallografie. Ze onderzochten 30 verschillende monsters, inclusief 14 Hsp104-begeleiders uit verschillende bronnen. In dit proces, een enkel kristal werd in vloeibare stikstof gedompeld en onderworpen aan harde röntgenstralen waaruit diffractiepatronen werden verzameld en de structuur werd gereconstrueerd. Alleen het eiwit uit de Calcarisporiella schimmel afgebogen tot een hoge resolutie, merkte Joachimiak op.
Om de structurele relatie van het eiwit in een levende cel beter te begrijpen, ze wendden zich vervolgens tot een onderzoek van het eiwit in oplossing. Monsters werden gescreend met behulp van elektronenmicroscopie aan de Universiteit van Chicago en vervolgens verzonden naar Stanford University, waar cryo-elektronenmicroscopen de moleculaire gegevens met hoge resolutie verzamelden die nodig zijn om de structuur te bepalen door middel van complexe berekeningen. Net als bij het kristalonderzoek, de Calcarisporiella voorbeeld gaf de beste resolutie.
Nu gewapend met de hoogste resolutie van Hsp104 in zowel kristalvorm als in oplossing, het team was in staat om voorheen onbekende of onzekere bepalingen te doen over de kenmerken en het gedrag van het eiwit.
Voorafgaand aan de ontdekking van het team, biologen geloofden dat Hsp104 vijf domeinen ondersteunde, onafhankelijke delen van het eiwit die specifieke functies vervullen. Maar de nieuwe high-fidelity-structuren onthulden niet alleen slechts vier domeinen, maar een duidelijker beeld van hoe ze zich tot elkaar verhouden.
Het N-terminale domein, bijvoorbeeld, wordt verondersteld te binden aan een verkeerd gevouwen eiwit en het te helpen ontvouwen in een lineaire vorm. Hierdoor kan het door een smal centraal kanaal in de hexameer gaan dat is gemaakt door twee AAA-domeinen (ATPases Associated with different cellular Activities). Het eiwit wordt geleid, of verplaatst, door dit kanaal naar de andere kant van de hexameer, waar het nu een nieuwe kans heeft om correct te folden.
"Mensen beweerden eerder dat een andere, het C-terminale domein, was essentieel voor de vorming van het hexameer, maar we hebben aangetoond dat dit niet waar is, " zei Joachimiak. "Het heeft geen interactie met andere subeenheden, maar kan werken als een aanlegplaats voor andere chaperonnes om eiwitten te helpen hervouwen."
Een andere belangrijke vondst hielp de lang gekoesterde overtuiging dat de hexameren van Hsp104 plat waren, teniet te doen. Beide onderzoeksmethoden bewezen ondubbelzinnig dat ze spiraalvormig zijn, om onderzoekers te helpen begrijpen hoe de chaperonne het 'reparatiekanaal' vormt.
Het team is van plan door te gaan met het verkennen van de vele en gevarieerde chaperonnes die buiten het menselijk genoom bestaan. Ze geloven dat deze chaperonnes kunnen dienen als een therapeutische strategie met het potentieel om eiwitten die tot ernstige ziekten kunnen leiden letterlijk te ontrafelen.
"Het is mogelijk dat er andere begeleiders zijn die beter zijn dan de onze, en dat ze in staat zullen zijn om eiwitten te behandelen die zich ophopen in de hersenen en ziekten veroorzaken, " zei Joachimiak. "Dat zou echt fantastisch zijn."
De krant, "Structuur van Calcarisporiella thermophila Hsp104-disaggregase dat verschillende proteotoxische misfolding-gebeurtenissen tegenwerkt, " verschijnt in het online nummer van 27 december van het tijdschrift Structuur . Naast Joachimiak, Argonne-onderzoeker Karolina Michalska droeg bij aan dit onderzoek.
 Recept voor voedselmechanica om gezond voedsel te serveren dat lang meegaat
Recept voor voedselmechanica om gezond voedsel te serveren dat lang meegaat Een nieuwe methode voor proximity-labeling op nanometerschaal die zich richt op histidine-residuen
Een nieuwe methode voor proximity-labeling op nanometerschaal die zich richt op histidine-residuen Een solide weg naar waterstofopslag
Een solide weg naar waterstofopslag Hittegeharde magnesiumlegering een sterke keuze voor implantaten
Hittegeharde magnesiumlegering een sterke keuze voor implantaten Wat is schadelijk voor de ozonlaag?
Wat is schadelijk voor de ozonlaag?
 Schade ontdekt op Antarctische gletsjers onthult zorgwekkende tekenen voor zeespiegelstijging
Schade ontdekt op Antarctische gletsjers onthult zorgwekkende tekenen voor zeespiegelstijging Wat zijn de belangrijkste soorten terrestrische ecosystemen?
Wat zijn de belangrijkste soorten terrestrische ecosystemen?  Inheemse dieren en planten gevonden in Mississippi
Inheemse dieren en planten gevonden in Mississippi  Nesting Habits of Wild Rabbits
Nesting Habits of Wild Rabbits  Analyse van titanium in oude rotsen zorgt voor omwenteling in de geschiedenis van de vroege aarde
Analyse van titanium in oude rotsen zorgt voor omwenteling in de geschiedenis van de vroege aarde
Hoofdlijnen
- Menselijke evolutie: tijdlijn, stadia, theorieën en bewijsmateriaal
- Een geïntegreerde beoordeling van vaatplantensoorten in Amerika
- Als een soort niet over voldoende genenpool beschikt,
- Saharastof:het goede,
- Wanneer is lachen een medisch symptoom?
- Baanbrekende ontdekking van een geurdetecterende receptorversterker
- Processen die ATP gebruiken als energiebron
- Bronnen van het lactase-enzym
- Moeten we de genen van buitengewone mensen sparen voor klonen?
- Wetenschappers ontwikkelen efficiënte multifunctionele katalysator voor CO2-hydrogenering tot benzine
- Nieuwe RNA-modificerende tool corrigeert genetische ziekten, inclusief aanjager van triple-negatieve borstkanker

- Van de bronstijd tot voedselblikken, hier is hoe tin de mensheid heeft veranderd

- Nieuwe genomische methode onthult atomaire rangschikkingen van batterijmateriaal
- Nieuwe bio-geïnspireerde dynamische materialen transformeren zichzelf
 Telecom Italia bord hangt op, kiest de strijd om de controle
Telecom Italia bord hangt op, kiest de strijd om de controle Klimaatverandering begint stinkend te worden: hier is hoe je letterlijke bergen vol met Poop
Klimaatverandering begint stinkend te worden: hier is hoe je letterlijke bergen vol met Poop Op een robot gemonteerde vacuümgrijpers buigen hun kunstmatige spieren
Op een robot gemonteerde vacuümgrijpers buigen hun kunstmatige spieren UAW-werknemers bekrachtigen nieuw contract met Fiat Chrysler
UAW-werknemers bekrachtigen nieuw contract met Fiat Chrysler Hoe Reishi Mushrooms
Hoe Reishi Mushrooms Een prebiotische route naar DNA
Een prebiotische route naar DNA Giftige emissies omlaag, maar er sterven nog steeds mensen door luchtvervuiling – het is tijd voor iets radicaals
Giftige emissies omlaag, maar er sterven nog steeds mensen door luchtvervuiling – het is tijd voor iets radicaals Bewijs gevonden van magnetische herverbinding die spicules op de zon genereert
Bewijs gevonden van magnetische herverbinding die spicules op de zon genereert
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

