
Wetenschap
Eerste-van-zijn-soort blik op de innerlijke werking van biologische eiwitcomplexen
Eiwitten spelen een cruciale rol in het menselijk lichaam. Deze complexe moleculen helpen de structuur en functie van organen en weefsels te behouden, het reguleren van cellulaire activiteit op het meest fundamentele niveau.
Het begrijpen van de manier waarop deze eiwitten werken, zou de sleutel kunnen zijn om ze te gebruiken in de strijd tegen ziekten - een idee dat scheikundigen van de Universiteit van Zuid-Florida hebben omgezet in vooruitgang.
Een nieuwe studie, onder leiding van USF-assistent-hoogleraar Scheikunde Ioannis Gelis, doctoraat, gepubliceerd in Natuurcommunicatie , geeft onderzoekers een nooit eerder geziene blik in de innerlijke werking van het Hsp90-Cdc37-kinase-eiwitcomplex.
Een eiwitcomplex is een groep individuele eiwitmoleculen die samenkomen en met elkaar interageren. Bijna elk cellulair proces vereist de vorming van deze complexen om goed te kunnen functioneren. Echter, vaak, vooral in de aanwezigheid van celmutaties zoals bij kankerpatiënten, deze complexen kunnen de progressie van de ziekte verder bevorderen.
"Als we erin slagen te begrijpen hoe deze moleculaire machinerie werkt, we hopen dat we dan nieuwe strategieën kunnen ontwikkelen om deze eiwitten te remmen, ' zei Gelis.
In het eiwitcomplex dat is bestudeerd door het USF-onderzoeksteam, Hsp90 en Cdc37 fungeren als de chaperonne of helper-eiwitten, wat betekent dat het hun taak is om het "klant"-eiwit te activeren en te beschermen, in dit geval, een kinase. Eenmaal geactiveerd, het kinase faciliteert vervolgens een verscheidenheid aan andere cellulaire functies. Bij gezonde mensen dit is goed. Maar, voor kankercellen die gemuteerde kinasen dragen, bijvoorbeeld, goede werking van dit complex is slecht omdat het de progressie van kanker bevordert. In essentie, het beschermt kankercellen.
Gelis zegt dat het idee is om te voorkomen dat deze kankercellen functioneren zoals ze normaal zouden doen. De truc is om te voorkomen dat de chaperonne-eiwitten de cliënt activeren en beschermen, waardoor het bestaande afweermechanisme van de cel het gemuteerde eiwit op natuurlijke wijze kan afbreken.
"Er zijn veel bedrijven en academische groepen die actief werken aan de ontwikkeling van remmers die deze complexen zouden verstoren, " zei Gelis. "Ons werk laat zien hoe dit complex onder natuurlijke fysiologische omstandigheden verstoort."
Met behulp van nucleaire magnetische resonantie (NMR) spectroscopie, Gelis en zijn team waren in staat om hoge resolutie, driedimensionale afbeeldingen van deze eiwitten. De onderzoekers zagen dat de toevoeging van slechts enkele atomen aan Cdc37 (fosforylering), is een modificatie die resulteert in een significante structurele verandering van het eiwit. Zodra de initiële fosforylering plaatsvindt, Hsp90 ervaart zijn eigen modificatie waardoor het hele complex uit elkaar valt.
"Het is een zeer ingewikkeld en intrigerend mechanisme waardoor disassociatie optreedt in deze complexen, " zei Gelis. "De chemische modificatie in dat enkelvoudige eiwit is erg klein, maar het brengt een enorme conformationele verandering met zich mee die het hele complex beïnvloedt. De moleculaire details die in onze studie zijn onthuld, dragen bij aan een beter begrip van de functie van deze eiwitten en zullen helpen bij het ontwerpen van betere medicijnen voor de behandeling van kanker."
 Onderzoekers ontdekken dat moleculen dynamisch omslaan van magnetische naar niet-magnetische vormen
Onderzoekers ontdekken dat moleculen dynamisch omslaan van magnetische naar niet-magnetische vormen Biofilms als bouwvakkers
Biofilms als bouwvakkers Veelzijdige sensor tegen tumor-initiërende cellen
Veelzijdige sensor tegen tumor-initiërende cellen Nieuwe digitale filterbenadering heeft tot doel chemische metingen te verbeteren
Nieuwe digitale filterbenadering heeft tot doel chemische metingen te verbeteren Het beheersen van de nanoschaalstructuur van membranen is essentieel voor schoon water, onderzoekers vinden
Het beheersen van de nanoschaalstructuur van membranen is essentieel voor schoon water, onderzoekers vinden
 Record Britse regenval in winter 2013-14 veroorzaakt door tropen, stratosfeer en klimaatopwarming
Record Britse regenval in winter 2013-14 veroorzaakt door tropen, stratosfeer en klimaatopwarming Onderzoekers ontdekken een nieuwe tool voor het reconstrueren van oud zee-ijs om klimaatverandering te bestuderen
Onderzoekers ontdekken een nieuwe tool voor het reconstrueren van oud zee-ijs om klimaatverandering te bestuderen China zegt dat de luchtkwaliteit in 2017 is verbeterd
China zegt dat de luchtkwaliteit in 2017 is verbeterd Hoe wordt gas gewonnen uit schalie?
Hoe wordt gas gewonnen uit schalie?  3 doden, staatshoofdstad geteisterd terwijl stormen Missouri teisteren
3 doden, staatshoofdstad geteisterd terwijl stormen Missouri teisteren
Hoofdlijnen
- Wat is het belang van nucleïnezuren?
- Nieuw zenuwdegeneratiemolecuul geïdentificeerd
- Processen die ATP
- Cellulaire ademhaling: definitie, vergelijking en stappen
- Eenmaal uitgestorven verklaard, Lord Howe Island wandelende takken leven echt
- Live hersenactiviteit volgen met de nieuwe NeuBtracker open-source microscoop
- Een grote stap in de richting van het verminderen van streptokokken bij op de boerderij gekweekte tilapia
- Hoe antibioticagebruik bij dieren bijdraagt aan antibioticaresistentie
- Top 5 manieren om plezier te hebben in 2050
- De moleculaire complexiteit van cellulaire machines en omgevingsprocessen ontrafelen

- Bindingsmechanisme met eenmaal korting kan de sleutel zijn om virussen te targeten
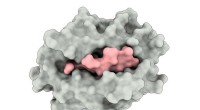
- Nieuwe test vindt nieuw mechanisme dat ten grondslag ligt aan veroudering van rode bloedcellen
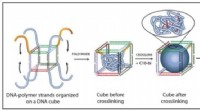
- DNA-strengen gebruiken om nieuwe polymeermaterialen te ontwerpen
- Supercomputing meer licht dan warmte

 Wat geven de kleuren aan op een pH-teststrookpapier?
Wat geven de kleuren aan op een pH-teststrookpapier?  Tijd om je zorgen te maken:Silicon Valley wil je gedachten lezen
Tijd om je zorgen te maken:Silicon Valley wil je gedachten lezen Landen met de hoogste sterfte door vervuiling, sterftecijfers
Landen met de hoogste sterfte door vervuiling, sterftecijfers Onderzoekers ontwikkelen een vloot van 16 miniatuurauto's voor coöperatieve rij-experimenten
Onderzoekers ontwikkelen een vloot van 16 miniatuurauto's voor coöperatieve rij-experimenten Quantum snelheidslimieten zijn niet echt kwantum
Quantum snelheidslimieten zijn niet echt kwantum Hoge inzet, diepgewortelde belangen en het terugdraaien van milieuregelgeving door Trump
Hoge inzet, diepgewortelde belangen en het terugdraaien van milieuregelgeving door Trump NASA ziet Atlantics Leslie een orkaan worden
NASA ziet Atlantics Leslie een orkaan worden Supersnelle methode voor keramische productie zou de deur kunnen openen naar AI-gestuurde materiaalontdekking
Supersnelle methode voor keramische productie zou de deur kunnen openen naar AI-gestuurde materiaalontdekking
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

