
Wetenschap
Nabij-infrarood fotoactiveerbare oxygenatiekatalysatoren van amyloïde peptide
Krediet:Japan Science and Technology Agency (JST)
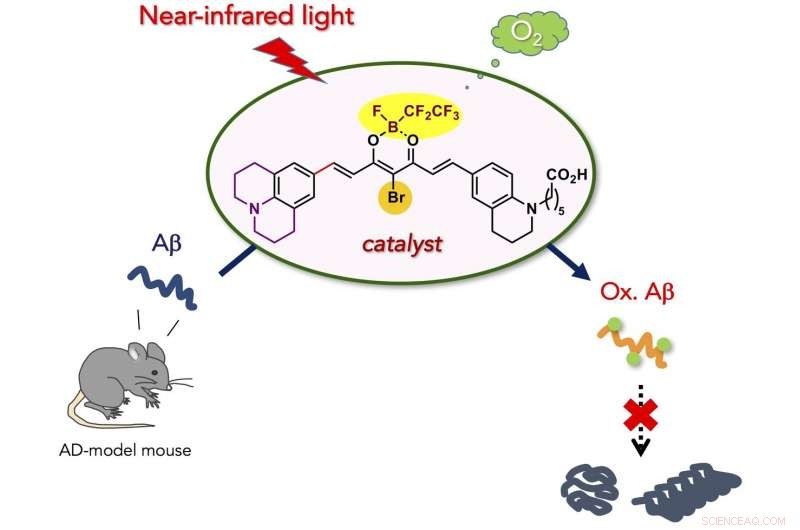
een nieuwe, Er is een biocompatibele foto-oxygenatiekatalysator ontwikkeld die de pathogene aggregatie van aan de ziekte van Alzheimer (AD) gerelateerd amyloïde-β-peptide (Aβ) selectief kan oxygeneren en afbreken onder bestraling met nabij-infrarood (NIR) licht. De katalysator was in staat om Aβ te oxygeneren dat zich onder de huid van een levende muis bevindt, en verminderd intact Aβ-niveau in AD-model muizenhersenen. De nieuwe katalysator is mogelijk toepasbaar voor de behandeling van perifere amyloïde ziekten en AD.
Toxische aggregatie van amyloïde peptide en eiwit is nauw verwant aan een aantal menselijke ziekten. Amyloïde-β (Aβ) is een representatief amyloïde-peptide waarvan de aggregatie verband houdt met de pathogenese van de ziekte van Alzheimer (AD). De ontwikkeling van een kunstmatig chemisch systeem dat selectief giftige amyloïde-aggregaten omzet in niet-toxische soorten onder fysiologische omstandigheden, waardoor mogelijk het pathogene proces wordt onderdrukt, zou een nieuwe therapeutische strategie kunnen zijn voor de behandeling van momenteel ongeneeslijke amyloïde ziekten, inclusief AD.
De onderzoekers stelden zich voor dat fotogekatalyseerde aerobe oxygenatie een geschikte chemische reactie zou zijn om de pathogene aggregatieve eigenschappen van Aβ onder fysiologische omstandigheden te verzwakken. Omdat peptide- en eiwitaggregatie in het algemeen afhangt van intermoleculaire hydrofobe interacties, covalente installatie van hydrofiele zuurstofatomen op een peptide of eiwit (d.w.z. oxygenatie) zou de aggregatieve eigenschap verminderen. We hebben eerder gemeld dat aërobe oxygenatie van Aβ plaatsvindt in aanwezigheid van op Flavine (vitamine B2) gebaseerde fotokatalysatoren, en het resulterende geoxygeneerde Aβ vertoont een zeer laag aggregatief vermogen en toxiciteit. Daarna, selectievere foto-oxygenatiekatalysatoren, alleen geactiveerd bij het detecteren van een toxische amyloïde structuur van hogere orde, werden ontwikkeld op basis van een fluorescentieprobe voor geaggregeerd amyloïde peptide en eiwit. In vivo toepassing van de katalysatoren was, echter, onhaalbaar, omdat bestraling met zichtbaar licht, die een lage weefselpenetratie heeft, nodig was voor de excitatie van de katalysator. Voor in vivo toepassing, fotokatalysatoren moeten kunnen functioneren onder excitatie met licht met een langere golflengte, aangeduid als het "optische venster" waarin levend weefsel relatief weinig licht absorbeert.
Hier, we hebben een biocompatibele foto-oxygenatiekatalysator ontwikkeld die de pathogene aggregatie van Aβ selectief kan oxygeneren en afbreken onder bijna-infrarood (NIR) lichtbestraling. De katalysator vertoonde vier belangrijke voordelen in vergelijking met de vorige katalysatoren voor het afbreken van geaggregeerd en toxisch Aβ:(1) Hoge selectiviteit voor geaggregeerd Aβ die voortkomt uit de hogere-orde amyloïde structuur-detectie aan/uit-schakelaar voor de katalysatoractiviteit. De precieze doelselectiviteit maakte fotooxygenatie van geaggregeerd Aβ mogelijk in aanwezigheid van de cellen en in lysaat van muizenhersenen. (2) Lage toxiciteit voor de cellen. Structurele optimalisatie van de katalysator verminderde de cytotoxiciteit aanzienlijk, zowel in het donker als onder NIR-bestraling. (3) Hoge oxygenatiepotentie onder NIR-fotobestraling. Vanwege de weefselpermeabiliteit van NIR-licht, fotooxygenatie van geaggregeerd Aβ onder de huid van de muis was mogelijk in hoge opbrengst. (4) Toepasbaarheid op de hersenen van levende dieren in vivo. Injectie van de katalysator in het AD-model muizenbrein samen met bestraling met NIR-licht leidde tot een significante afname van het intacte Aβ-niveau in de hersenen. De resultaten die in deze studie zijn verkregen, zijn een belangrijke stap naar het gebruik van kunstmatige katalyse als een potentiële therapeutische strategie tegen amyloïde ziekten.
 Een nieuwe strategie om 2-D anorganische materialen te synthetiseren die in condensatoren worden gebruikt, batterijen, en composieten
Een nieuwe strategie om 2-D anorganische materialen te synthetiseren die in condensatoren worden gebruikt, batterijen, en composieten Verschil tussen polystyreen en polyurethaan
Verschil tussen polystyreen en polyurethaan Hoe een cent te roesten
Hoe een cent te roesten  Onderzoekers creëren vloeistofafstotende substantie die op alle oppervlakken werkt
Onderzoekers creëren vloeistofafstotende substantie die op alle oppervlakken werkt Wetenschappers bepalen de structuur van glasvormend eiwit in sponzen
Wetenschappers bepalen de structuur van glasvormend eiwit in sponzen
 Wat is de levensduur van een lieveheersbeestje?
Wat is de levensduur van een lieveheersbeestje?  Oproep voor een wereldwijd verbod op loodverf
Oproep voor een wereldwijd verbod op loodverf Kleine satellieten spelen een rol bij het beoordelen van atmosferische deeltjes, uit onderzoek blijkt
Kleine satellieten spelen een rol bij het beoordelen van atmosferische deeltjes, uit onderzoek blijkt Nieuwe studie analyseert oorzaken van aardverschuiving 2010 in Saint-Jude, Quebec
Nieuwe studie analyseert oorzaken van aardverschuiving 2010 in Saint-Jude, Quebec De waarde van zeegras bij het veiligstellen van een duurzame planeet
De waarde van zeegras bij het veiligstellen van een duurzame planeet
Hoofdlijnen
- Gevolgen van de microscoop op Science
- Hoe branden het gezicht van de toendra veranderen
- Overeenkomsten en verschillen tussen osmose en diffusie
- Projectideeën om het menselijke spijsverteringsstelsel te laten zien op de middelbare school voor studenten
- Expeditie om de zuidelijke rechtse walvissen rond Zuid-Georgië te controleren op gezondheid
- Verontwaardiging na koala gevonden vastgeschroefd aan paal in Australië
- CRISPR-dragende nanodeeltjes bewerken het genoom
- Hoe je je handen kunt wassen om sperma te doden
- Hoeveel spieren heb je nodig om te glimlachen?
- Een manier om water te gebruiken om methaan om te zetten in methanol

- Draagbare gasdetectie krimpt naar nieuwe dimensies

- Een zeldzame prestatie:materiaal beschermt tegen zowel biologische als chemische bedreigingen
- Nieuwe DNA-amplificatiecapsule belooft veel voor de bestrijding van ziekten
- Zoekmachine voor slim hout

 Afbeelding:Sojoez klaar om te rollen
Afbeelding:Sojoez klaar om te rollen Lijst met celorganellen en hun functies
Lijst met celorganellen en hun functies Hoe bouw je een robot die de bewegingen van dieren nabootst - en waarom zou je dat willen?
Hoe bouw je een robot die de bewegingen van dieren nabootst - en waarom zou je dat willen? Zuid-Afrika verklaart droogte tot nationale ramp
Zuid-Afrika verklaart droogte tot nationale ramp Discovery wijst de weg naar grafeencircuits
Discovery wijst de weg naar grafeencircuits Nieuwe 3D-nanoprintstrategie opent de deur naar een revolutie in de geneeskunde, robotica
Nieuwe 3D-nanoprintstrategie opent de deur naar een revolutie in de geneeskunde, robotica COVID-19 in het toerisme:antropologisch inzicht in de banalisering van dood en leven
COVID-19 in het toerisme:antropologisch inzicht in de banalisering van dood en leven Wat is de oppervlaktesamenstelling van Saturnus?
Wat is de oppervlaktesamenstelling van Saturnus?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

