
Wetenschap
Eenvoudige éénpotssynthese van medicamenteuze tricyclische peptiden
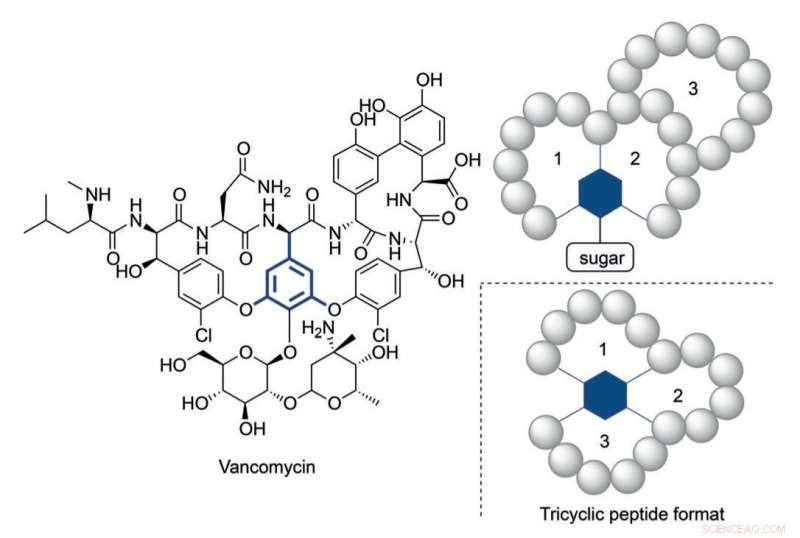
Structuur van vancomycine en een tricyclisch peptideformaat geïnspireerd op de multicyclische structuur. Krediet:HIMS
Chemici van het Van 't Hoff Instituut voor Moleculaire Wetenschappen (HIMS) en Pepscan (Lelystad) van de Universiteit van Amsterdam hebben een nieuwe methode ontwikkeld voor het vastzetten van lineaire peptiden in sterk starre tricyclische structuren met farmaceutisch potentieel. Hun bevindingen zijn zojuist gerapporteerd in Angewandte Chemie .
De methodiek, ontwikkeld door HIMS Ph.D. student Gaston Richelle, maakt de parallelle synthese van meerdere tricyclische peptiden in een bibliotheekformaat mogelijk. Dit maakt daaropvolgende biologische screening mogelijk om nieuwe therapeutische peptiden te identificeren.
Hoger niveau van structurele complexiteit
In het afgelopen decennium zijn cyclische peptiden naar voren gekomen als een veelbelovende klasse van therapieën, met een breed therapeutisch venster dat varieert van antifertiliteit tot antivirale en antikankertoepassingen. Er zijn veel monocyclische en bicyclische peptiden geïdentificeerd en het aantal cyclische peptiden dat in klinische studies terechtkomt, is drastisch toegenomen.
Toch, het is duidelijk geworden dat in sommige gevallen meer structureel complexe peptiden nodig zijn om geschikte activiteitsniveaus te bereiken. vancomycine, het 'laatste redmiddel' tricyclische antibioticum peptide, geeft een illustratief voorbeeld van een dergelijke complexe constructie. De alarmerend toenemende resistentie van bacteriën tegen de momenteel beschikbare antibiotica vraagt om complexe peptideconstructies naar analogie van vancomycine.
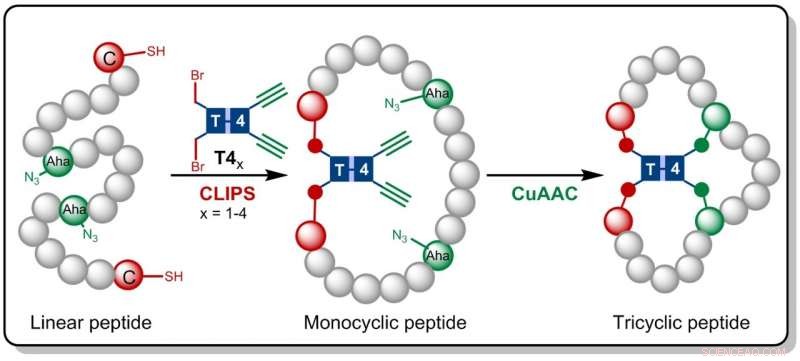
Krediet:HIMS
De zoektocht naar nieuwe synthetische routes naar complexe multicyclische peptiden heeft dus serieuze belangstelling gekregen. Eerder gerapporteerde methodologieën voor het maken van multicyclische peptiden waren beperkt vanwege de vorming van meerdere isomeren, moeizame reactieprotocollen of beperkte structurele diversiteit.
CLIPS gecombineerd met CuAAC
In het onderzoek dat nu is gepubliceerd in Angewandte Chemie , de Amsterdamse chemici bouwen voort op de eerder bij Pepscan ontwikkelde CLIPS-technologie. Deze methode voor 'chemische koppeling van peptiden op steigers' levert monocyclische en bicyclische peptiden op waarvan is aangetoond dat ze verhoogde selectiviteiten en affiniteiten tegen doeleiwitten vertonen.
Gaston Richelle heeft nu de CLIPS-methode gecombineerd met de volledig compatibele CuAAC 'klik'-chemie, wat leidt tot de vorming van de complexe tricyclische peptiden. Door gebruik te maken van flexibele scaffold moleculen, de gewilde tricyclische peptiden worden op een isomeer zuivere wijze gevormd. Het belangrijkste voordeel van de nieuwe methodologie is dat de CLIPS- en CuAAC-reacties kunnen worden uitgevoerd in een éénpotsprocedure zonder beperkingen aan de aard en hoeveelheden aminozuren die in de peptidelussen worden geïmplementeerd.
Als resultaat kan de methodologie worden toegepast in peptidebibliotheken met hoge diversiteit om een breed scala aan tricyclische topologieën te genereren die kunnen worden gescreend op biologische activiteit. Momenteel worden er meerdere inhibitiescreeningen uitgevoerd, bijv. tegen enzymen die zeer overvloedig aanwezig zijn in kankercellen in het eerste stadium. Ook worden nieuwe antimicrobiële activiteitsstudies uitgevoerd tegen MRSA en Staphylococcus aureus. Hieraan toevoegend, het onderzoeksteam bestudeert momenteel het gebruik van nog complexere T6-steigers om penta- en hexacyclische peptiden te maken.
 Stapsgewijze hydrideoverdracht in de biosynthese van chlorofyl
Stapsgewijze hydrideoverdracht in de biosynthese van chlorofyl Nieuwe benadering van moleculaire modellering kan de ontwikkeling van nieuwe organische materialen voor elektronica versnellen
Nieuwe benadering van moleculaire modellering kan de ontwikkeling van nieuwe organische materialen voor elektronica versnellen Twee beter dan één:scheikundigen bevorderen duurzame batterijtechnologie
Twee beter dan één:scheikundigen bevorderen duurzame batterijtechnologie Chlorofyl verwijderen van bladeren
Chlorofyl verwijderen van bladeren Zullen cyborgs gemaakt worden van melanine? Pigmentdoorbraak maakt biocompatibele elektronica mogelijk
Zullen cyborgs gemaakt worden van melanine? Pigmentdoorbraak maakt biocompatibele elektronica mogelijk
 Zware regenval maakt einde aan langdurige droogte in Southern Plains
Zware regenval maakt einde aan langdurige droogte in Southern Plains De effecten van topografie op het klimaat
De effecten van topografie op het klimaat  Geologisch bewijs ondersteunt de theorie dat een grote kosmische impactgebeurtenis plaatsvond rond 12, 800 jaar geleden
Geologisch bewijs ondersteunt de theorie dat een grote kosmische impactgebeurtenis plaatsvond rond 12, 800 jaar geleden Matching-commitment-overeenkomsten om klimaatactie te stimuleren
Matching-commitment-overeenkomsten om klimaatactie te stimuleren Muur van zand overspoelt Chinese stad
Muur van zand overspoelt Chinese stad
Hoofdlijnen
- Handelen of niet handelen? De ivoren impasse doorbreken
- Waarom zijn sommige dieren moeilijker te klonen dan andere?
- Wat is de structuur van stamcellen?
- Zwaarlijvige honden geholpen door effectieve gewichtsverliesproeven
- Onthulling van essentiële enzymen voor plantengroei tijdens stikstofgebrek
- Hoe een TAPPI-kaart te gebruiken
- Central Dogma (Gene Expression): Definitie, Stappen, Verordening
- Berekening van de tijd voor celverdubbeling
- Wat zijn endorfines?
- Nieuwe theorieën en materialen helpen de overgang naar schone energie

- Onderzoekers observeren het schakelen van Ras-eiwit in detail

- Snelle en efficiënte scheiding van olie en water bereikt door nieuw ontwikkelde deeltjes

- Onderzoekers onderzoeken manieren om antibiotica te verwijderen die meren en rivieren vervuilen

- Is zure regen schadelijk voor dieren?

 Het noorderlicht, oftewel aurora borealis, zou deze week naar een hemel bij jou in de buurt kunnen komen
Het noorderlicht, oftewel aurora borealis, zou deze week naar een hemel bij jou in de buurt kunnen komen Verborgen donoren spelen belangrijke rol in politieke campagnes
Verborgen donoren spelen belangrijke rol in politieke campagnes Kunstmatige esdoornzaden van raketten
Kunstmatige esdoornzaden van raketten De combinatie van zonnepanelen en grazende lammeren verhoogt de landproductiviteit, studie vondsten
De combinatie van zonnepanelen en grazende lammeren verhoogt de landproductiviteit, studie vondsten Wat is het verschil tussen een reeks en een reeks?
Wat is het verschil tussen een reeks en een reeks?  Bewijs van abnormaal grote supergeleidende opening op topologische oppervlaktetoestand van β-Bi2Pd dunne film
Bewijs van abnormaal grote supergeleidende opening op topologische oppervlaktetoestand van β-Bi2Pd dunne film Onderzoekers maken flexibele, transparant e-paper van siliconen
Onderzoekers maken flexibele, transparant e-paper van siliconen Nieuwe inzichten in de wereldwijde siliciumcyclus
Nieuwe inzichten in de wereldwijde siliciumcyclus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

