
Wetenschap
Succesvolle synthese van een nieuwe insuline-analoog
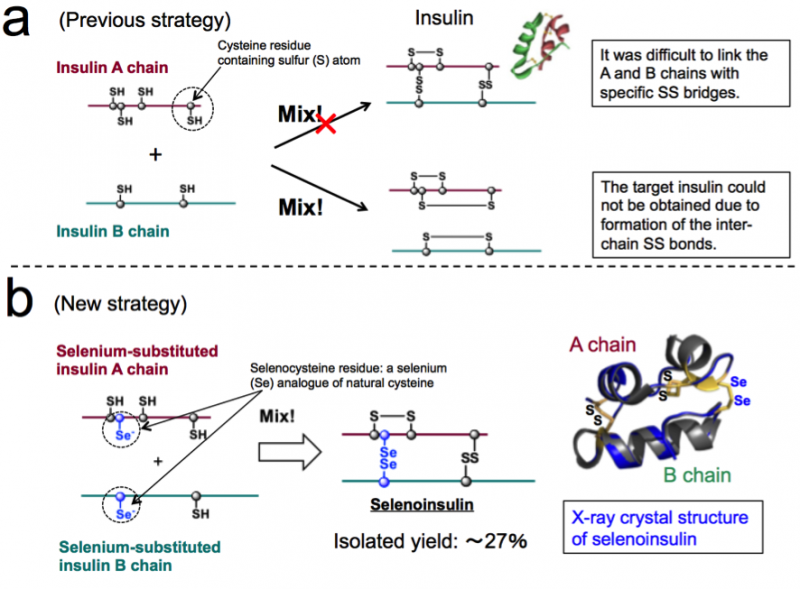
Figuur 1. Chemische synthese van insuline. (a) Vorige strategie gebaseerd op de koppeling tussen natieve insuline A- en B-ketens. (b) Nieuwe strategie waarbij gebruik wordt gemaakt van de unieke aard van selenocysteïne en de röntgenkristalstructuur van seleno-insuline. (Deze cijfers zijn geciteerd uit het oorspronkelijke artikel met aanpassingen.). Krediet:Universiteit van Osaka
Een groep onderzoekers heeft synthetische insuline-analogen seleno-insuline (Se-Ins) ontwikkeld door het disulfide tussen de ketens in runderpancreasinsuline (BPIns) te vervangen door een diselenidebrug.
Deze groep toonde aan dat Se-Ins een bijna identieke structuur en biologische activiteit hadden die vergelijkbaar was met die van BPins, en dat het een verbeterde weerstand had tegen IDE-degradatie. Dit is veelbelovend voor de toepassing van Se-Ins op een langdurig insulinepreparaat bij diabetestherapie.
Na in de bloedbaan te zijn gecirculeerd, insuline wordt afgebroken door een insuline-afbrekend enzym (IDE) in de nieren en uitgescheiden in de urine. Deze groep dacht dat de productie van insuline met een hoge weerstand tegen afbraak door IDE zou leiden tot de ontwikkeling van een nieuw type langwerkende insulinepreparaten die lang in het lichaam zouden kunnen circuleren.
Insuline bestaat uit twee polypeptideketens:A-keten en B-keten, verbonden door een disulfidebinding (Se−Se-binding), dus het is moeilijk om alleen insuline uit deze ketens te nemen vanwege Se−Se-bindingen. Dus, deze groep dacht dat als insuline A-ketens en B-ketens die selenium (Se) bevatten in plaats van zwavel (S), werden gebruikt, de diselenidebinding (Se−Se-binding) zou snel worden gevormd en dan zou de kettingassemblagereactie efficiënt kunnen worden uitgevoerd, aangezien Se reactiever is dan S.
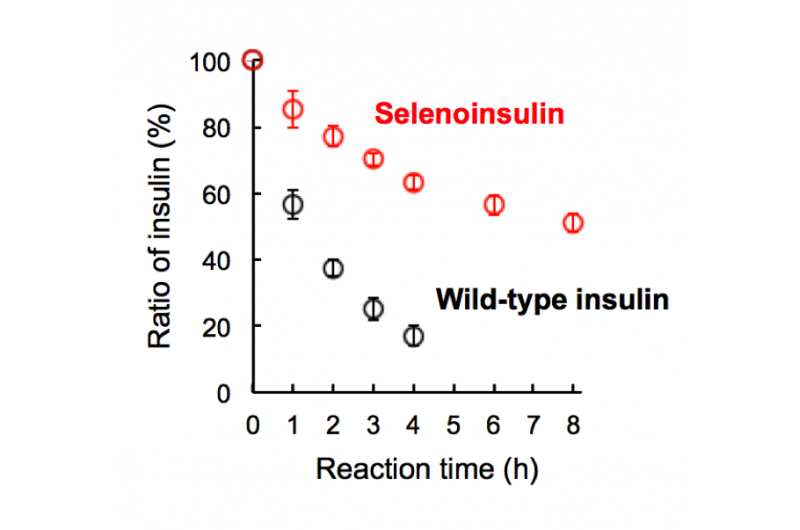
Figuur 2. Afbraak van seleno-insuline (rood) en wildtype insuline (zwart) door insuline-afbrekend enzym (IDE). (Dit cijfer is met kleine wijzigingen uit het oorspronkelijke artikel geciteerd.). Krediet:Universiteit van Osaka
In aanvulling, Se-Se-bindingen zijn stabieler dan S-S-bindingen, dus deze groep verwachtte dat Se-Se-bindingen extra structurele robuustheid zouden geven op de insulinevouw, wat resulteert in de verbeterde weerstand tegen IDE-degradatie vanwege de intrinsieke stabiliteit. Op basis van dit begrip, deze groep slaagde in de synthese van Se-bevattende insuline A- en B-ketens, evenals het verkrijgen van Se-Ins met een isolatieopbrengst tot 27% door peptideketens onder optimale omstandigheden te laten reageren.
Deze groep toonde aan dat Se-Ins een bijna identieke structuur hadden als die van BPIns, wat suggereert dat Se-Ins een biologische activiteit heeft die vergelijkbaar is met die van BPI's. Experimenten met de afbraak van BPIns en Se-Ins met behulp van IDE toonden aan dat de afbraaksnelheid van Se-Ins veel langzamer was dan die van BPIns. Van dit, men denkt dat Se-Ins een langdurig karakter heeft en een nieuwe klasse van langwerkende insuline-analogen voor diabetestherapie zou kunnen zijn.
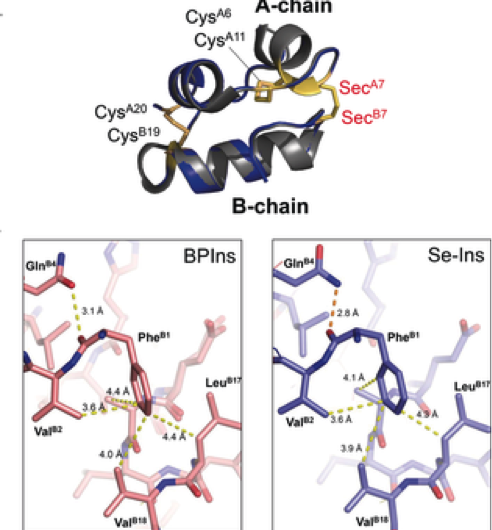
Figuur 3. Bereiding van seleno-insuline als een langdurig insuline-analoog. Krediet:Universiteit van Osaka
 Chemicus legt de wetenschap achter vuurwerk uit
Chemicus legt de wetenschap achter vuurwerk uit Brandstofcellen voor waterstofvoertuigen gaan langer mee
Brandstofcellen voor waterstofvoertuigen gaan langer mee Nieuw membraan kan de weg vrijmaken voor goedkope, efficiënt gemaakte biobrandstoffen
Nieuw membraan kan de weg vrijmaken voor goedkope, efficiënt gemaakte biobrandstoffen Neutronen onthullen snelle translatie van methaan op het grensvlak van twee clathraatstructuren
Neutronen onthullen snelle translatie van methaan op het grensvlak van twee clathraatstructuren Wat is de optimale pH voor menselijke maag-enzymactiviteit?
Wat is de optimale pH voor menselijke maag-enzymactiviteit?
Hoofdlijnen
- 2 Voorbeelden van Heterozygote eigenschappen
- Dit is waarschijnlijk waarom je een geest hebt gezien, volgens Science
- Hoe zuurstofgas wordt geproduceerd tijdens fotosynthese?
- Kunnen planten denken?
- Waarom heeft de evolutie ons niet het vermogen gegeven om zoet water te ruiken?
- Lijst van forensische technieken
- Zeldzame zangvogel heeft misschien nooit bestaan
- Studie identificeert walvisblaasmicrobioom
- Veel meer bacteriën hebben elektrisch geleidende filamenten
- De prestaties van het apparaat verfijnen met zwermen zwemmende cellen

- Nanocoating maakt lichtgewicht metaalschuim bothard en explosieveilig

- Wetenschappers ontdekken een nieuw complex europiumhydride

- Een betere bouwsteen voor het maken van nieuwe materialen
- P450-peroxygenase omzetten in peroxidase via mechanismegestuurde eiwittechnologie
 Waarom al dat geroezemoes over de supermaan?
Waarom al dat geroezemoes over de supermaan? Hoe de zeebodem in de Stille Oceaan zijn bocht van 60 graden kreeg
Hoe de zeebodem in de Stille Oceaan zijn bocht van 60 graden kreeg Google gebruiken om ons ecosysteem in kaart te brengen
Google gebruiken om ons ecosysteem in kaart te brengen Laser- en sensoronderzoek moet worden bevorderd door nieuwe onderzoeken naar plasmonisch-fotonische kristallen
Laser- en sensoronderzoek moet worden bevorderd door nieuwe onderzoeken naar plasmonisch-fotonische kristallen Onderzoekers verbeteren AI die aan je stem kan horen of je depressief bent
Onderzoekers verbeteren AI die aan je stem kan horen of je depressief bent Goedkopere koolstofafvang is onderweg
Goedkopere koolstofafvang is onderweg Subtielere vormen van intimidatie tasten het legitimiteitsgevoel van vrouwen in de natuurkunde aan
Subtielere vormen van intimidatie tasten het legitimiteitsgevoel van vrouwen in de natuurkunde aan Alle soorten eekhoorns
Alle soorten eekhoorns
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

