
Wetenschap
Een gereedschapskist voor het maken van nieuwe medicijnen
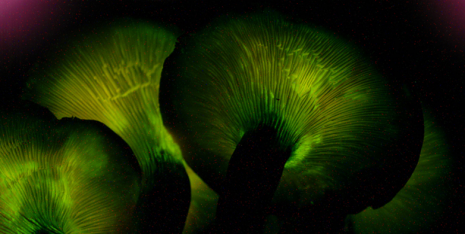
Deze schimmel zit vol verrassingen:de jack-o'-lantern-paddenstoel gloeit in het donker en produceert peptiden die nuttig kunnen zijn voor mensen. Krediet:Noah Siegel, wikicommons, CC BY-SA 3.0
ETH-microbiologen onder leiding van Markus Künzler hebben een opmerkelijk enzym ontdekt in een schimmel. Ze willen het nu gebruiken om nieuwe medicijnen te ontwikkelen.
Schimmels blijken een werkelijk onuitputtelijk reservoir aan nieuwe stoffen te bieden. Een van die schimmels is de jack-o'-lantern-paddenstoel (Omphalotus olearius), die overal in het Middellandse Zeegebied voorkomt en een vruchtlichaam heeft dat oplicht in het donker.
Maar het is niet dit speciale effect dat medische onderzoekers interesseert; het is een enzym dat onlangs is ontdekt door ETH-onderzoekers onder leiding van microbioloog Markus Künzler.
Dit enzym, opa, vormt een belangrijk onderdeel van een metabolische route die ongedierte weghoudt van de jack-o'-lantern-paddenstoel. "Schimmels beschermen zichzelf tegen roofdieren en concurrenten met behulp van een cocktail van gifstoffen, waarvan vele eiwitten of peptiden zijn, ", zegt Künzler.
De jack-o'-lantern-paddenstoel gebruikt het OphA-enzym om de ruggengraat van een van deze peptiden te voorzien van extra methylgroepen. Alleen bij deze chemische wijziging en daaropvolgende cyclisatie wordt het peptide, omphalotine A, functioneren als een toxine. De paddenstoel gebruikt het om ongedierte zoals rondwormen af te weren.
Een productielijn die moeilijk te manipuleren is
Schimmelpeptiden dienen ook als medicijnen in de geneeskunde. Een van de meest bekende is cyclosporine A, die is gebruikt bij orgaantransplantaties, auto-immuunziekten en kankergeneeskunde voor bijna 40 jaar.
Dit peptide draagt methylgroepen op zijn ruggengraat als omphalotin A. De ringvorm en de methylgroepen zijn verantwoordelijk voor de gunstige farmacologische eigenschappen van cyclosporine A, in het bijzonder de orale beschikbaarheid ervan – een factor die momenteel een belangrijk obstakel vormt voor op peptiden gebaseerde geneesmiddelen.
In tegenstelling tot omphalotine A, wiens ruggengraat, zoals die van de meeste eiwitten en peptiden in een cel, wordt geproduceerd door het ribosoom, cyclosporine A is opgebouwd uit aminozuren door een enorm enzym dat aan deze taak is gewijd. Dit enzym functioneert net als een productielijn in de auto-industrie. "Echter, het is moeilijk om deze productielijn biotechnologisch te veranderen om varianten van cyclosporine A te produceren, ", zegt Künzler.
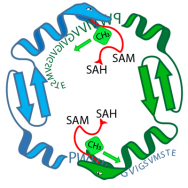
Het OphA-enzym (groene en blauwe slangen) rust een voorloperpeptide van omphalotin A (letterreeks) uit met methylgroepen. Tijdens deze fase, het enzym en het peptide zijn gebonden. Krediet:Niels van der Velden, Mike Freeman / ETH Zürich
Creatie van nieuwe ringvormige peptiden
Met behulp van het OphA-enzym, echter, het zou mogelijk kunnen zijn om nieuwe ringvormige peptiden te maken in plaats van simpelweg varianten van omphalotin A. Dankzij de methylgroepen die eraan vastzitten, deze nieuwe peptiden zouden even voordelige farmacologische eigenschappen hebben als die van cyclosporine A.
Deze mogelijkheid is te wijten aan het feit dat door OphA gemodificeerde peptiden ribosomaal worden geproduceerd en dus gemakkelijk kunnen worden gewijzigd via veranderingen in de voor peptide coderende genen. In aanvulling, OphA lijkt minder selectief te zijn over de peptiden die het chemisch kan veranderen. Het enzym is daarom in staat om methylgroepen te hechten aan een groot aantal verschillende peptiden.
"We kunnen biotechnologisch verschillende startpeptiden produceren en veranderen met OphA, waardoor we geheel nieuwe peptiden kunnen maken met farmacologisch voordelige eigenschappen, ", legt Künzler uit.
OphA maakt dus de productie mogelijk van bibliotheken van ringvormige peptiden met methylgroepen als basis voor de ontwikkeling van peptidegeneesmiddelen. Deze peptidebibliotheken zouden vervolgens kunnen worden gescreend op peptiden die een gewenst biologisch kenmerk vertonen, zoals het vermogen om te binden aan een doeleiwit bij kankertherapie.
Door de aangehechte methylgroepen, peptiden die op deze manier zijn geïdentificeerd, hebben een grote kans om gunstige farmacologische kenmerken te vertonen. Dit betekent dat ze veelbelovende leadpeptiden vertegenwoordigen voor de ontwikkeling van respectievelijke therapeutische peptiden. "Deze aanpak biedt duidelijke voordelen met betrekking tot kostenefficiëntie en kans op succes in vergelijking met benaderingen waarbij methylgroepen pas achteraf in het peptide worden geïntroduceerd, ’ zegt de microbioloog.
ETH Zürich heeft een patent aangevraagd voor het gebruik van OphA en verwante enzymen om methylgroepen in ribosomale peptiden in te voegen en voor de procedure die wordt gebruikt om overeenkomstige peptidebibliotheken te creëren. Künzler heeft een CTI-beurs ontvangen, momenteel zonder branchepartner, om het principe te bewijzen dat de technologie werkt. Een spin-off staat ook ter discussie. "Echter, we moeten het proof-of-concept voor de technologie leveren voordat we kunnen beginnen met het werven van fondsen voor een mogelijke spin-off." De komende twee jaar zullen dit plan waarschijnlijk maken of breken.
Enthousiaste experts
De resultaten van Künzler zijn enthousiast ontvangen door experts in het veld. De belangstelling voor zijn systeem was groot tijdens een recente conferentie over peptiden in Canada, en een bedrijf heeft ook interesse getoond in het verkrijgen van een licentie op het octrooi. "Het is leuk om fundamenteel onderzoek te begeleiden naar praktische toepassingen, ", zegt Künzler.
Hij gelooft dat schimmels het potentieel hebben om een breed scala aan natuurlijk voorkomende middelen te leveren. Er zijn miljoenen verschillende soorten schimmels, en het aantal veelbelovende natuurlijke stoffen is navenant groot. Echter, hij blijft een realist en erkent dat slechts een klein deel hiervan als medicijn zal worden toegepast. Misschien zitten er een paar uit zijn verzameling peptiden tussen.
 Waterstof voedt raketten, maar hoe zit het met stroom voor het dagelijks leven? kwamen dichterbij
Waterstof voedt raketten, maar hoe zit het met stroom voor het dagelijks leven? kwamen dichterbij Hier komt de zon
Hier komt de zon Röntgenstralen onthullen een verborgen eigenschap die leidt tot defecten in een lithium-ionbatterijmateriaal
Röntgenstralen onthullen een verborgen eigenschap die leidt tot defecten in een lithium-ionbatterijmateriaal Invriezen en smelten voor Kindergarten
Invriezen en smelten voor Kindergarten Het effect van oplossingsconcentratie op geleidbaarheid
Het effect van oplossingsconcentratie op geleidbaarheid
 3D terreinvisualisaties
3D terreinvisualisaties Conflict en droogte verwoesten de gewaardeerde dadelpalmen van Irak
Conflict en droogte verwoesten de gewaardeerde dadelpalmen van Irak Goudverkenning met elektromagnetische 3D-methode met gecontroleerde bron
Goudverkenning met elektromagnetische 3D-methode met gecontroleerde bron Deeltjes die worden uitgestoten door 3D-printers voor consumenten kunnen de luchtkwaliteit binnenshuis schaden
Deeltjes die worden uitgestoten door 3D-printers voor consumenten kunnen de luchtkwaliteit binnenshuis schaden Miljoenen worstelen zonder stroom terwijl dodelijke koudegolf de VS in zijn greep houdt
Miljoenen worstelen zonder stroom terwijl dodelijke koudegolf de VS in zijn greep houdt
Hoofdlijnen
- 3 Eigenschappen van een cel
- Genbewerking in de hersenen krijgt een grote upgrade
- Interessante feiten over plantencellen
- Een driedimensionaal model van een plantencel maken met labels
- Hoe werkt ADP naar ATP?
- Studie onderzoekt de impact van leeuwen die naast giraffenpopulaties leven
- Nieuwe insectensoort bootst dode bladeren na voor camouflage
- Het verschil tussen glycolyse en gluconeogenese
- Hoeveel chromosomen zijn er in cellen van het menselijk lichaam?
- Geavanceerde polymeren helpen de waterzuivering te stroomlijnen, milieusanering

- Zeer efficiënte katalysator met één atoom kan de auto-industrie helpen

- Nieuwe symmetriedoorbrekende methode opent weg voor bioactieve stoffen

- Nieuw polymeer kan de prestaties van organische en perovskiet-zonnecellen verbeteren

- Het vinden van vezelig eiwit kan leiden tot verbeterde bioprinting, tissue engineering
 Goedkopere koolstofafvang is onderweg
Goedkopere koolstofafvang is onderweg We hebben meer mensen nodig:uitgeputte brandweerlieden bestrijden Siberische branden
We hebben meer mensen nodig:uitgeputte brandweerlieden bestrijden Siberische branden Hoe schat ik de celgrootte met een microscoop?
Hoe schat ik de celgrootte met een microscoop?  Onthullingen over Hall-fouten wekken ambities voor 2D-materialen
Onthullingen over Hall-fouten wekken ambities voor 2D-materialen China's eerste Marslander gaat Tianwen heten
China's eerste Marslander gaat Tianwen heten Tyfoon Hagibis volgen vanuit de ruimte
Tyfoon Hagibis volgen vanuit de ruimte Bevordering van elektroreductie van stikstofmonoxide tot ammoniak via elektronenrijk Cu gemoduleerd door Ru-doping
Bevordering van elektroreductie van stikstofmonoxide tot ammoniak via elektronenrijk Cu gemoduleerd door Ru-doping Eerste aardobservatiesatelliet met AI klaar voor lancering
Eerste aardobservatiesatelliet met AI klaar voor lancering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

