
Wetenschap
Het separase-securine-complex oplossen
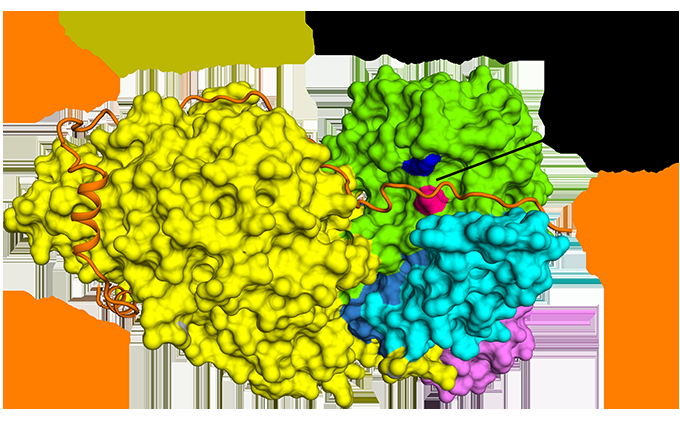
Figuur 1:De antiparallelle binding van securine in vergelijking met separase. Krediet:diamanten lichtbron
De structuur van een belangrijk eiwitcomplex dat de metafase-naar-anafase-overgang tijdens de voortgang van de celcyclus regelt, is opgelost met behulp van cryo-elektronenmicroscopie (cryo-EM) bij Diamond Light Source. De structuurstudie, gedetailleerd in Natuur Structurele en moleculaire biologie , heeft waardevolle inzichten opgeleverd in de innerlijke werking van het separase-securin-complex.
Separase is een enzym dat verantwoordelijk is voor het splitsen van de kleisin-subeenheden (Scc1 en Rec8) van de cohesin-ring die zusterchromatiden bij elkaar houdt tijdens mitose. Zodra de chromatiden zijn vrijgemaakt door separase, ze scheiden naar tegenovergestelde polen van de cel, klaar om nieuwe kernen te vormen in twee identieke dochtercellen. Separase wordt onder controle gehouden door een remmende chaperonne die bekend staat als securine, waarvan intrigerend wordt aangenomen dat het ook activerende eigenschappen heeft.
Hoewel bijna 20 jaar geleden ontdekt, het is pas recent dat de structuur van separase gebonden aan securine is opgehelderd. Cryo-EM werd uitgevoerd in het Electron Bio-Imaging Center (eBIC) bij Diamond om de structuur van het volledige complex te bepalen en om de moleculaire interactie tussen separase en securine te onderzoeken. Er werd ontdekt dat securine een verlengde conformatie vormt om te interageren over de gehele lengte van separase, en remt het enzym via een pseudosubstraatmechanisme op de actieve plaats. Een volledig begrip van deze interactie en de aard van celcycluscontrole zou nieuwe wegen kunnen openen voor gericht medicijnontwerp.
Een celcyclus regulerend complex
Wanneer chromosomen worden gerepliceerd, bevatten ze elk twee zusterchromatiden, en tijdens celdeling moeten deze chromatiden op een gecoördineerde en nauwkeurige manier scheiden om twee identieke dochterkernen te produceren. Aan het begin van de mitose, de zusterchromatiden worden bij elkaar gehouden door een eiwitcomplex dat cohesine wordt genoemd; echter, tijdens de metafase-naar-anafase-overgang wordt cohesine gesplitst door een protease-enzym dat bekend staat als separase om de chromatiden te scheiden en hen in staat te stellen naar tegenoverliggende zijden van de cel te bewegen net voordat deze zich deelt.
De overgang van metafase naar anafase begint wanneer een grote multi-subeenheid E3 ubiquitine ligase, het anafase-bevorderende complex (of APC/C) genoemd, markeert een remmende chaperonne, genaamd securin, met ubiquitine voor vernietiging. Zodra securine is afgebroken, separase is vrij om cohesine te splitsen en de chromatiden te scheiden.
Het separase-securine-complex is essentieel voor celdeling, toch was de structuur van dit duo nog niet helemaal opgelost. Dr. Andreas Boland, Postdoctoraal onderzoeker in de groep van Dr. David Barford aan het MRC Laboratory of Molecular Biology en co-hoofdonderzoeker van de studie legde uit waarom dit complex zo fascinerend is:"De verkeerde segregatie van genetisch materiaal kan leiden tot aneuploïdie en tumorigenese, daarom is dit een van de belangrijkste stappen tijdens de voortgang van de celcyclus. Paradoxaal genoeg, securin voorkomt niet alleen voortijdige splitsing van cohesine, maar het kan ook separase-activiteit bevorderen. Om de dubbele mechanismen van activering en repressie in detail te begrijpen, hebben we cryo-EM met één deeltje gebruikt."
Cryo-EM-structuur met een resolutie van 3,8
Separase-securine-complexen van zowel C. elegans als mensen werden tot expressie gebracht, gezuiverd, en aangebracht op met grafeenoxide bedekte gouden koolstofrasters voordat ze worden ingevroren in vloeibaar ethaan. Cryo-EM-microfoto's werden verzameld met behulp van de Titan Krios-microscoop bij eBIC met een gekalibreerde vergroting van 47, 619, wat overeenkomt met een pixelgrootte van 1,05 .
Dr. Boland wees op de waarde van cryo-EM voor deze toepassing:"De eiwitcomplexen zijn relatief klein van formaat, met minder dan 250 kDa voor de mens en slechts ongeveer 150 kDa voor het C. elegans-complex, maar ze bevatten meerdere domeinen en zijn flexibel, dus het waren uitdagende materialen om te kristalliseren. Cryo-EM is zelfs voor kleine eiwitcomplexen als deze een haalbare optie."
Voor de eerste keer ooit, cryo-EM werd gebruikt om de bijna-atomaire resolutiestructuur van het C. elegans separase-securin-complex te bepalen. Verder, de structuur van het menselijke equivalent van het complex werd opgelost tot een gemiddelde resolutie, het onthullen van het evolutionaire behoud van de driehoekige vorm van separase.
Met Cryo-EM kon het team visualiseren hoe securine omgaat met separase. Het neemt een verlengde anti-parallelle conformatie aan om te binden aan hydrofobe plekken over de gehele lengte van separase. nieuwsgierig, deze hydrofobe interacties bleken ook separase te stabiliseren, mogelijk de activerende effecten van securine op separase verklaren. Bovendien, securine interageert met de katalytische plaats van separase via een pseudosubstraatmechanisme. Een arginineresidu dat aanwezig is op de P1-splitsingspositie in de cohesinesubstraten Sccl en Rec8 wordt in securine vervangen door een hydrofoob residu. Deze substitutie is verantwoordelijk voor het vervormen van de geometrie van de separase-katalytische plaats op de substraatsplitsingspositie, waardoor de protease-activiteit ervan wordt geblokkeerd.
Separase is cruciaal voor de voortgang van de celcyclus, dus het zou een interessant farmaceutisch doelwit kunnen zijn. Mutaties, overexpressie, en mislokalisatie van separase is geassocieerd met tumorontwikkelingen zoals borstkanker.
Dr. Boland is van plan het complex verder te bestuderen:"In de toekomst we willen de resolutie van het menselijke separase-securine-complex verbeteren om een atomaire of bijna-atomaire resolutie te bereiken. We zouden ook graag willen begrijpen hoe het separase-securine-complex wordt gebonden en alomtegenwoordig wordt door de APC/C om het te markeren voor vernietiging, dus we zullen cryo-EM voor dit doel blijven gebruiken."
 Hoe een plantaardig dieet kan helpen klimaatverandering tegen te gaan en stress te verminderen
Hoe een plantaardig dieet kan helpen klimaatverandering tegen te gaan en stress te verminderen Methaanbronnen in Parijs in kaart brengen
Methaanbronnen in Parijs in kaart brengen Klimaatverandering:kinderen veroveren een plaats in de politiek, nu moeten volwassenen luisteren en handelen
Klimaatverandering:kinderen veroveren een plaats in de politiek, nu moeten volwassenen luisteren en handelen Morielpaddestoelen jagen in Indiana
Morielpaddestoelen jagen in Indiana Onderzoekers ontdekken dat de effecten van klimaatverandering tegen het midden van de eeuw kunnen versnellen
Onderzoekers ontdekken dat de effecten van klimaatverandering tegen het midden van de eeuw kunnen versnellen
Hoofdlijnen
- Kun je leven zonder zuurstof? Dit dier kan
- Hebben mensen en bananen echt 50 procent van hetzelfde DNA?
- Waarom was frenologie een rage in de Victoriaanse tijd?
- 3 soorten mutaties die kunnen optreden in het DNA Molecuul
- Staan we aan het begin van het einde van de westerse beschaving?
- Wat is lachtherapie?
- Arctisch, grote visserslanden zijn het erover eens dat er niet gevist wordt in het noordpoolgebied, voor nu
- Karkas van Noord-Atlantische rechtse walvis gespot in Massachusetts
- Camponotini-mierensoorten hebben hun eigen verschillende microbiomen
- Topologiecontrole van menselijke fibroblastcellen monolaag door vloeibaar kristalelastomeer

- Chemici gebruiken gemodificeerde DNA-nucleotiden om nieuwe materialen te maken

- Gouden microjuwelen uit de 3D-printer

- Chemici ontwikkelen bio-geïnspireerde strategie voor de gecontroleerde synthese van polyenen

- Het nieuwe peptide van biologen kan veel kankers bestrijden
 Kunstmatige intelligentie gebruiken om materiaaleigenschappen te ontwikkelen
Kunstmatige intelligentie gebruiken om materiaaleigenschappen te ontwikkelen Het beste van twee werelden:hoge entropie ontmoet lage dimensies, opent oneindige mogelijkheden
Het beste van twee werelden:hoge entropie ontmoet lage dimensies, opent oneindige mogelijkheden Waarom kunnen bepaalde Bugs op het water lopen?
Waarom kunnen bepaalde Bugs op het water lopen?  Ultrazware zwarte gaten ontdekt in verre sterrenstelsels
Ultrazware zwarte gaten ontdekt in verre sterrenstelsels Uitharden met één druk op de knop - koolstofvezelcomposieten en onderwaterlijmen
Uitharden met één druk op de knop - koolstofvezelcomposieten en onderwaterlijmen Hoe motorstroom te berekenen met kronkelende weerstand
Hoe motorstroom te berekenen met kronkelende weerstand  Vogels van de Florida Panhandle
Vogels van de Florida Panhandle  Onderzoekers melden doorbraak in gedistribueerd diep leren
Onderzoekers melden doorbraak in gedistribueerd diep leren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

