
Wetenschap
Wat zorgt ervoor dat moleculen van een bepaald eiwit altijd in dezelfde vorm vouwen?
1. Aminozuursequentie:
* De primaire structuur: De volgorde van aminozuren in een eiwit is de fundamentele bepalende factor voor zijn vorm. Elk aminozuur heeft unieke eigenschappen (hydrofoob, hydrofiel, geladen, enz.) Die beïnvloeden hoe het interageert met zijn buren.
* interacties: Deze interacties omvatten:
* waterstofbinding: Vormen tussen polaire aminozuren.
* Hydrofobe interacties: Niet -polaire aminozuren hebben de neiging om samen te clusteren en contact met water te vermijden.
* ionische interacties: Komen op tussen tegengesteld geladen aminozuren.
* van der Waals krachten: Zwakke attracties tussen alle atomen.
2. Vouwpad:
* chaperones: Eiwitten genaamd chaperones helpen bij het vouwproces, waardoor misfolding en aggregatie voorkomen.
* Tussenliggende toestanden: Het vouwproces omvat vaak meerdere tussenliggende toestanden, waarbij het eiwit verschillende conformaties onderzoekt voordat het zijn uiteindelijke, stabiele vorm bereikt.
* vouwtrechter: Dit is een theoretisch model dat het vouwproces beschrijft als een reis door een trechter, met de laatste, gevouwen toestand die het laagste energiepunt vertegenwoordigt.
3. Thermodynamische stabiliteit:
* De native status: De gevouwen, functionele vorm van een eiwit wordt de natieve toestand genoemd. Het is de meest stabiele conformatie, waardoor vrije energie wordt geminimaliseerd.
* Energetische overwegingen: De native toestand vertegenwoordigt een evenwicht tussen de krachten die de gevouwen structuur en de entropische kosten van het beperken van de beweging van het eiwit stabiliseren.
Samenvattend: De specifieke sequentie van aminozuren bepaalt de interacties die optreden tijdens het vouwen, wat leidt tot een specifieke, lage energie-conformatie (de native toestand). Dit proces wordt geleid door chaperones en omvat tussenliggende toestanden. De inheemse toestand vertegenwoordigt de meest stabiele vorm, waardoor vrije energie wordt geminimaliseerd.
Belangrijke opmerking: Hoewel de primaire structuur de uiteindelijke vorm bepaalt, kunnen andere factoren het vouwen beïnvloeden, waaronder:
* Temperatuur: Extreme temperaturen kunnen eiwitvouwen verstoren.
* pH: Veranderingen in pH kunnen de ladingen van aminozuren veranderen, waardoor interacties worden beïnvloed.
* Aanwezigheid van andere moleculen: Bindende partners of andere moleculen kunnen het vouwproces beïnvloeden.
Deze factoren verklaren waarom eiwitvouwen een complex en ingewikkeld proces is, maar ook waarom een bepaald eiwit consequent in dezelfde vorm vouwt, wat leidt tot de specifieke functie ervan.
 Onzekerheden over overstromingsrisico's beoordeeld op wereldwijde schaal
Onzekerheden over overstromingsrisico's beoordeeld op wereldwijde schaal Hoe werkt het boren naar olie in het noordpoolgebied?
Hoe werkt het boren naar olie in het noordpoolgebied?  Beschermde gebieden kunnen de nationale economie van Brazilië helpen stimuleren, studie vondsten
Beschermde gebieden kunnen de nationale economie van Brazilië helpen stimuleren, studie vondsten Wat is omgevingsfactor?
Wat is omgevingsfactor?  Vernietiging regenwoud door goudwinning bereikt recordhoogte in Peru
Vernietiging regenwoud door goudwinning bereikt recordhoogte in Peru
Hoofdlijnen
- Wat zijn de kenmerken van virussen?
- Wat is de functie van teenstructuur op een rotifer?
- 'Superkracht' van chimpansees en wat dit zou kunnen betekenen in de menselijke spierevolutie
- Doorbraak helpt verklaren hoe DNA in onze cellen is georganiseerd
- Welk deel van de hersenen van de dieren is verantwoordelijk voor basisfuncties zoals ademhaling en pols?
- Wat is Ikolai -bacteriën?
- Hoe cellen in vorm blijven
- Wat regelt alle mobiele activiteiten?
- Hoe cellen hun mRNA-voorraad en de output ervan beheren
- Wetenschappers zeggen dat een One Health-benadering van plantgezondheid van vitaal belang is voor het bereiken van duurzame wereldwijde voedselzekerheid

- Zal er ooit een gelukkige pil zijn?
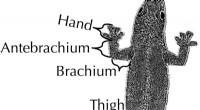
- Boomklimmende gekko's die smallere zitstokken gebruiken, hebben langere ledematen dan verwacht
- Bewijs dat energiemetabolisme en regulatie van biofilmvorming in bacteriën met elkaar verweven zijn
- Geliefde hondenrassen zullen net zo vaak bijten als verboden hondenrassen. Hier leest u hoe u ze kunt stoppen

 Hoe het epigenetische landschap de binding van pioniertranscriptiefactoren moduleert
Hoe het epigenetische landschap de binding van pioniertranscriptiefactoren moduleert  Draaiende haken van grafenen, chemisch neefje, kunnen een revolutie teweegbrengen in het werk van elektronenmicroscopen
Draaiende haken van grafenen, chemisch neefje, kunnen een revolutie teweegbrengen in het werk van elektronenmicroscopen Kleine bubbels gevormd door grote organische moleculen?
Kleine bubbels gevormd door grote organische moleculen?  Rekbare draadloze sensor kan de genezing van cerebrale aneurysma's volgen
Rekbare draadloze sensor kan de genezing van cerebrale aneurysma's volgen Lange snuiten beschermen vossen als ze met hun hoofd in de sneeuw duiken, zo blijkt uit onderzoek
Lange snuiten beschermen vossen als ze met hun hoofd in de sneeuw duiken, zo blijkt uit onderzoek  Heeft u een interne dialoog? Niet iedereen doet dat
Heeft u een interne dialoog? Niet iedereen doet dat  Experimenten met bifluoride-ionen tonen bewijs van hybride bindingen
Experimenten met bifluoride-ionen tonen bewijs van hybride bindingen New Englands 1816 Makreeljaar en klimaatverandering vandaag
New Englands 1816 Makreeljaar en klimaatverandering vandaag
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

