
Wetenschap
Welke eenheid wordt gebruikt om de diameter van een elektronenwolk te meten?
Dit is waarom:
* kwantummechanica: Elektronen in een atoom hebben geen vaste banen zoals planeten rond een ster. Ze bestaan in fuzzy, op waarschijnlijkheid gebaseerde regio's die orbitalen worden genoemd.
* waarschijnlijkheidsverdeling: De elektronenwolk vertegenwoordigt de kans om een elektron op een bepaald punt in de ruimte te vinden. Het is dichter waar het elektron waarschijnlijker wordt gevonden.
* Geen scherpe grens: Er is geen duidelijke rand naar de elektronenwolk. De kans op het vinden van een elektron neemt geleidelijk af naarmate je verder van de kern beweegt, maar het bereikt nooit echt nul.
In plaats van een diameter gebruiken we andere concepten om elektronenwolken te beschrijven:
* Atomische straal: Dit is een maat voor de gemiddelde afstand tussen de kern en de buitenste elektronenschil. Het is een meer praktische manier om de grootte van een atoom te beschrijven.
* Elektronenconfiguratie: Dit beschrijft de opstelling van elektronen in verschillende energieniveaus en orbitalen in het atoom. Dit geeft ons veel informatie over de vorm en eigenschappen van de elektronenwolk.
Dus hoewel we de "diameter" van een elektronenwolk niet meten, kunnen we deze andere concepten gebruiken om de grootte en structuur ervan te begrijpen.
 Gevaarlijk gebruik van pesticiden:wat er moet gebeuren om de gezondheid van Kenianen te beschermen
Gevaarlijk gebruik van pesticiden:wat er moet gebeuren om de gezondheid van Kenianen te beschermen  Wat is de molariteit van 100 ml oplossingswater en 11,7 g na CL?
Wat is de molariteit van 100 ml oplossingswater en 11,7 g na CL?  Hoe maak ik 70 procent isopropylalcohol?
Hoe maak ik 70 procent isopropylalcohol?  Welk metaal heeft twee valentie -elektronen?
Welk metaal heeft twee valentie -elektronen?  Het aantal sp2-sp2 hybride sigma-bindingen in de volgende verbinding is?
Het aantal sp2-sp2 hybride sigma-bindingen in de volgende verbinding is?
 Hoe Caterpillar schrankladers en multi-terrain werken
Hoe Caterpillar schrankladers en multi-terrain werken  Door de moessonoverstromingen zijn duizenden gestrand in India
Door de moessonoverstromingen zijn duizenden gestrand in India Wat betekent wandelende herfst?
Wat betekent wandelende herfst?  Geven soldaten om het milieu? Een studie in Zuid-Afrika suggereert van wel
Geven soldaten om het milieu? Een studie in Zuid-Afrika suggereert van wel Nieuw onderzoek laat zien hoe 'groene eilanden' bossen helpen regenereren na brand
Nieuw onderzoek laat zien hoe 'groene eilanden' bossen helpen regenereren na brand
Hoofdlijnen
- Hoe maak je een DNA-model van kralen en rietjes
- Welke koninkrijken hebben alleen prokaryotisch ingepakt?
- Welke organel wordt biochemische machine genoemd en waarom?
- Het verhaal van de paarse tomaat – en waarom het succes ervan een overwinning is voor genetisch gemodificeerd voedsel
- 'S Werelds kleinste bandrecorder is gemaakt van microben
- Hoe 'winnaar- en verliezerseffecten' de sociale rangorde van dieren en mensen beïnvloeden
- Westerse steden proberen te voorkomen dat hongerige beren ravage aanrichten
- Organellen die niet deelnemen aan eiwitsynthese?
- Studie brengt nieuw inzicht in hoe fundamentele DNA-sequenties de genactiviteit bepalen
- Onderzoeker berekent optimale banen naar Mars en Mercurius voor een ruimtevaartuig met elektrische voortstuwing
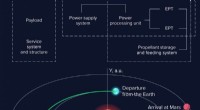
- NASA test stuurautomaatsensoren tijdens simulaties

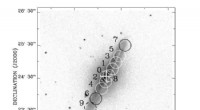
- Onderzoek geeft inzicht in moleculair gas in het massieve spiraalstelsel NGC 5908
- NASA activeert Deep Space Atomic Clock

- NASA Goddards Web Around Asteroid Bennu toont in SIGGRAPH filmfestival

 Wie zijn de klimaatactivisten van vandaag? Drie grote mythen wegnemen voor Earth Month
Wie zijn de klimaatactivisten van vandaag? Drie grote mythen wegnemen voor Earth Month  Zijn vrouwen minder corrupt? Nieuw onderzoek suggereert dat dit afhangt van culturele verwachtingen
Zijn vrouwen minder corrupt? Nieuw onderzoek suggereert dat dit afhangt van culturele verwachtingen  Chinese fossiele eieren laten zien dat dinosauriërs vóór uitsterven zijn uitgestorven
Chinese fossiele eieren laten zien dat dinosauriërs vóór uitsterven zijn uitgestorven  Wat zijn organische moleculen die reacties in levende systemen katalyseren?
Wat zijn organische moleculen die reacties in levende systemen katalyseren?  Welke term wordt gebruikt om alle fysiologische activiteiten weer te geven die door een A -organisme zijn uitgevoerd?
Welke term wordt gebruikt om alle fysiologische activiteiten weer te geven die door een A -organisme zijn uitgevoerd?  Wat is een organel in het cytoplasma dat energie voor cel levert?
Wat is een organel in het cytoplasma dat energie voor cel levert?  Hoe een transistor nummer te weten
Hoe een transistor nummer te weten  Luchtvaartmaatschappijen boos over riskante Brexit-impasse
Luchtvaartmaatschappijen boos over riskante Brexit-impasse
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

