
Wetenschap
Een nieuwe microscoop onthult het wonder van moleculaire zuurstof

Artist's impression van de interactie van de triplettoestand (blauwe pijlen) van een individueel pentaceenmolecuul (zwart en wit) met een zuurstofmolecuul (rood). Krediet:Jascha Repp
Onderzoekers van de Universiteit van Regensburg volgen de eerste stap in de reactie van één enkel kleurstofpigment met zuurstof met een ongekende resolutie.
Waarom vervagen de kleuren van een t-shirt na verloop van tijd in de zon? Waarom krijg je zonnebrand, en waarom worden de bladeren van een boom bruin in de herfst? Deze vragen hebben allemaal één thema gemeen:de wisselwerking tussen kleurstofpigmenten en omgevingszuurstof. Elk kind leert op school over deze chemische reactie, dat is het oxidatieproces in de lucht die we inademen. Dus wat kan er nog worden overgelaten aan onderzoek?
Zuurstof is een verbazingwekkende molecule omdat het magnetisch is. In vloeibare vorm, bij zeer lage temperaturen, het kan worden opgepakt door een magneet, net zoals ijzervijlsel dat kan. Deze eigenschap is gerelateerd aan de elektronen in de zuurstof. Alle moleculen zijn opgebouwd uit atoomkernen en elektronen, die zich gedragen als minuscule naalden van een kompas. Gebruikelijk, deze naalden rangschikken in paren die in tegengestelde richtingen wijzen zodat hun magnetische krachten opheffen. In een zuurstofmolecuul bestaande uit twee zuurstofatomen, echter, de twee kompasnaalden wijzen in dezelfde richting, zuurstof magnetisch maken.
kleurstof moleculen, zoals die gebruikt worden om een t-shirt te kleuren, zijn niet magnetisch omdat de kompasnaalden van de elektronen in tegengestelde richtingen wijzen. Als er licht op zo'n molecuul schijnt, een bepaalde kleur van het licht wordt geabsorbeerd, waardoor de kleurstof zijn karakteristieke uiterlijk krijgt. In dit proces van lichtabsorptie, de energie van het licht wordt overgedragen op een elektron in het kleurstofmolecuul, het verbreken van de oorspronkelijke koppeling van twee elektronen en het toestaan dat de kompasnaald van het aangeslagen elektron spontaan zijn uitlijning verandert. Wanneer dit proces plaatsvindt, het elektron kan niet meer terugkeren naar zijn oorspronkelijke staat. Het kleurstofmolecuul wordt magnetisch, het invoeren van wat een "triplet-toestand" wordt genoemd.
Een internationaal onderzoeksteam onder leiding van prof. Jascha Repp is er nu in geslaagd om te onthullen hoe deze triplet-energie wordt overgedragen van één enkel kleurstofmolecuul naar één enkel zuurstofmolecuul. Dit proces is een integraal onderdeel van het dagelijks leven, waar veel oxidatiereacties verlopen via de aangeslagen triplettoestand. Zolang het molecuul zich in deze toestand bevindt, het behoudt de energie die het door het licht krijgt, waardoor chemische reacties worden vergemakkelijkt. De meeste chemische reacties, zoals verbranding, enige initiële energie nodig hebben, zoals een vonk om te beginnen.
Een volledige dissipatie van de energie in het kleurstofmolecuul vereist een nieuwe omkering van de uitlijning van de elektronische kompasnaald, wat een langzaam en onwaarschijnlijk proces is. Alternatief, de lichtenergie in het kleurstofmolecuul, wat overeenkomt met een magnetische energie, kan eenvoudig overgaan op een ander magnetisch molecuul, zoals zuurstof - een proces dat lijkt op het omdraaien van een staafmagneet door een andere in de buurt te draaien. Deze overdracht van energie deactiveert het kleurstofmolecuul, maar het heeft de neiging om het zuurstofmolecuul zelf zeer reactief te maken, uiteindelijk het kleurstofmolecuul vernietigen. Dit effect is te zien bij gebleekte t-shirts of zonnebrand, waar de kleurstofmoleculen de pigmenten in de huid zijn.
Het team is erin geslaagd deze energieoverdracht tussen de kleurstof en het zuurstofmolecuul direct in de ruimte te volgen. zonder het kleurstofmolecuul te vernietigen. Om dit te doen, enkele moleculen werden op een oppervlak geplaatst en afgekoeld tot zeer lage temperaturen die dicht bij die van het heelal lagen. Met behulp van een zogenaamde "atoomkrachtmicroscoop", bestaande uit een zeer fijne naald met slechts één enkel atoom aan de punt, de onderzoekers konden de individuele atomen van het kleurstofmolecuul in beeld brengen door de punt erover te scannen. Door een reeks elektrische pulsen toe te passen op het kleurstofmolecuul, ze konden het op een gecontroleerde manier in de magnetische triplet-toestand drijven. De energieoverdracht van deze geëxciteerde triplettoestand naar zuurstofmoleculen in de buurt werd vervolgens in de tijd gevolgd door minuscule veranderingen in de kracht die op de punt werkt te meten.
Deze nieuwe benadering, gemeld in Wetenschap , stelde de onderzoekers in staat om veel verschillende geometrieën van de rangschikking van kleurstofmolecuul en zuurstof te onderzoeken. Op deze manier, het samenspel tussen moleculaire arrangementen op atomair niveau en de snelheid waarmee een dergelijke energieoverdracht plaatsvindt, zou voor het eerst kunnen worden opgelost. De wetenschappers willen nu eindelijk een onderliggend microscopisch raamwerk van fundamentele oxidatiereacties kunnen formuleren. Naast de hinderlijke vervaging van t-shirts, een dergelijk samenspel tussen moleculaire triplet-excitaties is van centraal belang voor een reeks technologische ontwikkelingen, zoals in organische lichtemitterende diodes (OLED's) en organische zonnecellen, in fotokatalytische energieomzetting en fotosynthese, en bij fotodynamische kankertherapie.
 Catastrofale overstromingen kunnen leiden tot hervestiging van mensen weg van rivieren
Catastrofale overstromingen kunnen leiden tot hervestiging van mensen weg van rivieren Klimaatverandering zal de toekomstige beschikbaarheid van water voor waterkracht en openbare watervoorziening in Wales beïnvloeden
Klimaatverandering zal de toekomstige beschikbaarheid van water voor waterkracht en openbare watervoorziening in Wales beïnvloeden Klimaatverandering negeren is alleen maar duurder geworden
Klimaatverandering negeren is alleen maar duurder geworden Brandweerlieden stabiliseren brand Canarische Eilanden, de meeste bewoners gaan naar huis
Brandweerlieden stabiliseren brand Canarische Eilanden, de meeste bewoners gaan naar huis Vergeet slimme steden (voor een minuut), we moeten praten over slimme boerderijen
Vergeet slimme steden (voor een minuut), we moeten praten over slimme boerderijen
Hoofdlijnen
- Onderzoeker rapporteert belangrijke componenten van antivirale verdediging van honingbijen
- Onderzoekers identificeren moleculaire motor die chromosomen transformeert
- Cellen puilen uit om door barrières te persen
- Wat is de laatste gemeenschappelijke voorouder?
- Voorbeelden van stoffen die gefaciliteerde diffusie gebruiken
- Is intelligentie een genetisch kenmerk?
- Is er eerder enige vorm van exploratie op Mercurius gedaan
- De bergleeuw in de wijk San Francisco is verdoofd
- Kan glucose door het celmembraan diffunderen door eenvoudige diffusie?
- Onderzoekers rapporteren over celdoorlatende nanobodies
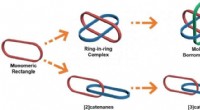
- Alles-in-één strategie voor metalla[3]catenanen, Borromeïsche ringen en ring-in-ring-complex
- Proces verwijdert tegelijkertijd giftige metalen en zout om schoon water te produceren

- Levende mitochondriën in ongekend detail gezien:fotobleken in STED-microscopie overwonnen
- Onderzoekers synthetiseren genezende verbindingen in schorpioengif

 Plasticvervuiling bouwt zich op in Arctische wateren:studie
Plasticvervuiling bouwt zich op in Arctische wateren:studie Hoe ontstaan kationen?
Hoe ontstaan kationen?  Waarom worden spuitdrums koud als u ze spuit?
Waarom worden spuitdrums koud als u ze spuit?  Potentiële energie: wat is het en waarom het ertoe doet (met formule en voorbeelden)
Potentiële energie: wat is het en waarom het ertoe doet (met formule en voorbeelden)  Wat is een gestandaardiseerde variabele in de biologie?
Wat is een gestandaardiseerde variabele in de biologie?  Welke planeet heeft een storm die eeuwenlang heeft gewoed?
Welke planeet heeft een storm die eeuwenlang heeft gewoed?  De wateren testen:verschillende vaste toestanden van water op andere planeten en manen analyseren
De wateren testen:verschillende vaste toestanden van water op andere planeten en manen analyseren Hubbles hemelse sneeuwbol
Hubbles hemelse sneeuwbol
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

