
Wetenschap
Onderzoek toont aan dat genetisch gemanipuleerde blaasjes zich beter op kankercellen richten
Twee ongelukkige feiten over chemotherapie:het kan zowel gezonde als kankercellen beschadigen, en veel therapeutische doelwitten blijven binnen de kankercellen, waardoor ze moeilijker te bereiken zijn.
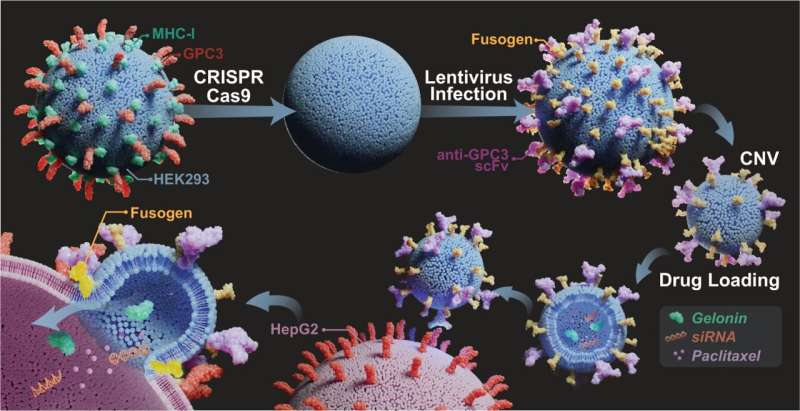
Biomedische ingenieurs van de Universiteit van Binghamton behoren tot degenen die onderzoek doen naar het gebruik van van cellen afkomstige nanoblaasjes om therapeutische middelen met betere nauwkeurigheid en efficiëntie aan het binnenste van kankercellen af te geven. De kleine zakjes met eiwitten, lipiden en RNA die cellen afscheiden als methode voor intercellulaire communicatie zouden kunnen worden aangepast om medicijnen te vervoeren.
"Deze nanodragers hebben een aantal uitstekende eigenschappen", zegt Yuan Wan, assistent-professor aan het Thomas J. Watson College of Engineering and Applied Science's Department of Biomedical Engineering. "Ze kunnen bijvoorbeeld worden geoogst uit menselijke celstammen, dus de immuunrespons is erg laag. Dat zorgt voor optimale biocompatibiliteit, zodat ze de immuunklaring omzeilen en een langere bloedhalfwaardetijd hebben. De tijd voor circulatie door het lichaam is misschien 45 seconden, zodat de met medicijnen gevulde nanoblaasjes vele malen veilig naar de tumoren kunnen reizen en de medicijnen een grotere kans hebben om door kankercellen te worden opgenomen in vergelijking met medicijnen die vrijelijk in het lichaam worden geïntroduceerd.
"Grote hoeveelheden ingekapselde medicijnen kunnen goed worden beschermd en vastgehouden door de lipidemembranen van de nanoblaasjes. Zodra kankercellen deze nanoblaasjes opnemen, doden hoge medicijnconcentraties in de micro-omgeving van de tumor kankercellen effectief. Ter vergelijking:vrije medicijnen kunnen snel diffunderen en vervolgens worden gereinigd Slechts een zeer kleine hoeveelheid medicijnen bereikt de tumoren, waardoor de werkzaamheid van de behandeling erg laag is. Je kunt de dosis verhogen, maar een hogere dosis resulteert ook in een hoge systematische toxiciteit."
In hun nieuwe onderzoek, gepubliceerd in Nature Communications , experimenteerde het Binghamton-team met doelgerichte groepen en ontwikkelde virale fusogenen, dit zijn eiwitten die het richten op kanker en de fusie van celmembranen vergemakkelijken.
Door tot overexpressie gebrachte of kankerspecifieke antigenen te identificeren die voorkomen in kwaadaardige cellen en door doelgerichte groepen en met fusogen uitgeruste nanoblaasjes te gebruiken, worden ingekapselde medicijnen in kankercellen geïnjecteerd terwijl gezonde cellen met rust worden gelaten.
"Mensen gebruiken op grote schaal nanodragers die bekend staan als met polymeer gedecoreerde liposomen, en ze zijn al goedgekeurd door de FDA," zei Wan. "Maar ze zijn niet perfect, omdat ze geen enkel kankergericht effect hebben en zeer ernstige immunogeniciteitsproblemen kunnen hebben [waardoor een reactie van het immuunsysteem wordt teweeggebracht]."
In 2021 deed Wan onderzoek om uit plasma afkomstige extracellulaire blaasjes te testen om te diagnosticeren of solitaire longknobbeltjes die in menselijke longen worden aangetroffen, goedaardig of kwaadaardig zijn. Andere methoden om maligniteit vast te stellen duren te lang of zijn invasiever.
Door die kennis te benutten, maakt dit huidige, maar afzonderlijke onderzoek gebruik van nanoblaasjes, zodat ze voor ons werken en specifiek zijn in wat ze beïnvloeden. Idealiter zouden artsen deze doelgerichte groepen en met fusogen uitgeruste nanoblaasjes kunnen voorbereiden voor gebruik bij veiliger vaccintoediening en genetische manipulatie.
Wat de toekomst betreft, zei Wan:"We moeten de doeltreffendheid van hun behandeling aantonen in grote diermodellen en aantonen dat we geen grote hoeveelheid van deze blaasjes nodig hebben omdat we de membraanfusiefunctie hebben. Als je het aantal verlaagt blaasjes en medicijnen die u nodig heeft, verlaagt u de kosten van de behandeling en de bijwerkingen."
Meer informatie: Lixue Wang et al., Bio-geïnspireerde techniek van fusogen en het richten op met groepen uitgeruste nanoblaasjes, Nature Communications (2023). DOI:10.1038/s41467-023-39181-2
Journaalinformatie: Natuurcommunicatie
Aangeboden door Binghamton University
 Water was een winnaar in het opvangen van koolstofdioxide
Water was een winnaar in het opvangen van koolstofdioxide Nieuwe hydrogels zijn veelbelovend bij de behandeling van botdefecten
Nieuwe hydrogels zijn veelbelovend bij de behandeling van botdefecten Optisch beeldvormingssysteem kan een ongekend aantal cellen in een enkele afbeelding vastleggen
Optisch beeldvormingssysteem kan een ongekend aantal cellen in een enkele afbeelding vastleggen Wat gebeurt er met ionische en covalente verbindingen wanneer ze oplossen in water?
Wat gebeurt er met ionische en covalente verbindingen wanneer ze oplossen in water?  Na twee uur, zonnebrandcrème met zinkoxide verliest effectiviteit, wordt giftig:studeren
Na twee uur, zonnebrandcrème met zinkoxide verliest effectiviteit, wordt giftig:studeren
Hoofdlijnen
- Sleuteleiwit reguleert de immuunrespons op virussen in zoogdiercellen
- Opwarming van de oceaan signaleert verandering van dieet voor Europese aalscholvers
- Wat is Ceramide?
- Klimaatverandering is de meest prominente bedreiging voor bestuivers, zo blijkt uit onderzoek
- Met behulp van nieuwe techniek doen onderzoekers verrassende ontdekkingen over hoe vliegenhersenen reageren op smaken
- Wat is de laatste gemeenschappelijke voorouder?
- Lignine-afval aangepast voor industrieel gebruik van bio-olie
- Onderzoek toont aan dat planten het gebruik van corrigerende Tipp-Ex-eiwitten beperken
- Hoe klimaatverandering planten onder druk zet en hun groei verandert
- Nieuwe methode voor het bestuderen van individuele defecten in transistors

- Duwende print op grootschalige piëzo-elektrische materialen

- Gebruik maken van plasmonica, ingenieurs lassen nanodraden met licht

- De contouren van levende cellen vastleggen met nieuwe nano-imaging-techniek met behulp van grafeen

- In harmonie met het hart van een koperatoom

 NASA's CloudSat beëindigt de missie door in het hart van de wolken te turen
NASA's CloudSat beëindigt de missie door in het hart van de wolken te turen  Nieuwe ontwerpstrategie kan helpen bij het verbeteren van gelaagde supergeleidende materialen
Nieuwe ontwerpstrategie kan helpen bij het verbeteren van gelaagde supergeleidende materialen Nieuwe architectuur kan essentieel zijn voor hoogwaardige kwantumfotonische circuits
Nieuwe architectuur kan essentieel zijn voor hoogwaardige kwantumfotonische circuits Milieueffecten van olie-extractie
Milieueffecten van olie-extractie Een nieuwe generatie synchrotron
Een nieuwe generatie synchrotron Van cellen afgeleide nanodragers voor efficiëntere en directere intracellulaire geneesmiddelafgifte
Van cellen afgeleide nanodragers voor efficiëntere en directere intracellulaire geneesmiddelafgifte  Wat als Apple sociale media zou gebruiken - zou het wrikken?
Wat als Apple sociale media zou gebruiken - zou het wrikken? Machines fluisteren onze geheimen:spionnen kunnen leren wat een machine maakt van de geluiden die het maakt
Machines fluisteren onze geheimen:spionnen kunnen leren wat een machine maakt van de geluiden die het maakt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

