
Wetenschap
Hybride nanobuisjes gebruiken om de behandeling van kanker te verbeteren met intracellulaire eiwitafgifte
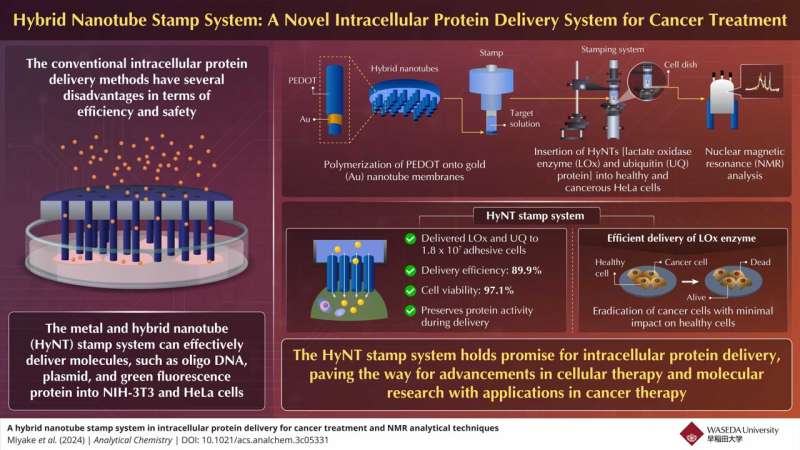
De intracellulaire afgifte van eiwitten is een belangrijke techniek voor het onthullen van de cellulaire functies, de structuur van het eiwitcomplex en de therapieën. Conventionele bezorgmethoden hebben echter verschillende beperkingen.
Om dit aan te pakken hebben onderzoekers uit Japan een nieuw hybride nanobuisjes (HyNT)-stempelsysteem ontwikkeld dat meerdere eiwitten met hoge efficiëntie en levensvatbaarheid kan leveren. Dit systeem vertegenwoordigt een vooruitgang in de intracellulaire eiwitafgifte en biedt nauwkeurige injectie van therapeutische middelen in doelcellen.
In het huidige medische landschap winnen precisiegeneeskunde en gerichte therapieën aan populariteit vanwege hun vermogen om behandelingen op individuele patiënten af te stemmen en tegelijkertijd de bijwerkingen te minimaliseren.
Conventionele methoden, zoals technieken voor genoverdracht, zijn veelbelovend in het rechtstreeks afleveren van therapeutische genen aan cellen om verschillende ziekten aan te pakken. Deze methoden hebben echter aanzienlijke nadelen, waardoor de werkzaamheid en veiligheid ervan wordt belemmerd.
Intracellulaire eiwitafgifte biedt een veelbelovende aanpak voor het ontwikkelen van veiligere, meer gerichte en effectieve therapieën. Door eiwitten rechtstreeks naar doelcellen over te brengen, omzeilt deze methode problemen zoals het stilleggen tijdens transcriptie en translatie en het risico op ongewenste mutaties door DNA-insertie. Bovendien maakt intracellulaire eiwitafgifte een nauwkeurige distributie van therapeutische eiwitten binnen doelcellen mogelijk zonder toxiciteit te veroorzaken.
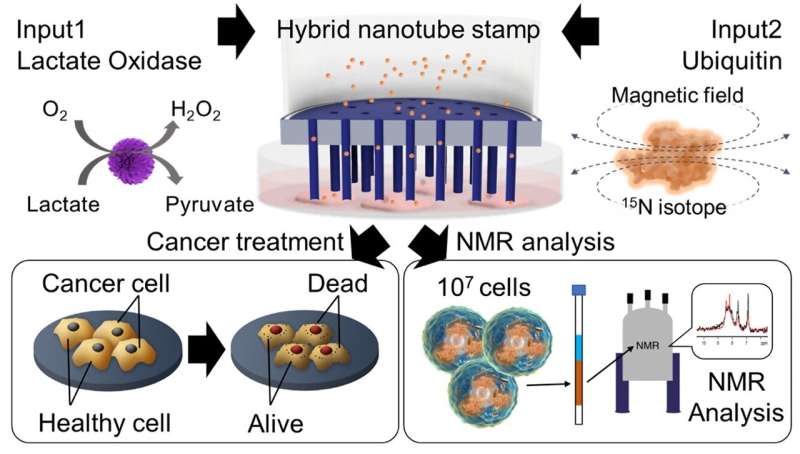
Een groep onderzoekers onder leiding van professor Takeo Miyake van de Waseda Universiteit, Japan, in samenwerking met de Mikawa Group van het RIKEN Instituut, heeft nu een hybride nanobuisjesstempelsysteem ontwikkeld voor de intracellulaire afgifte van eiwitten. Deze innovatieve techniek maakt de gelijktijdige levering van diverse ladingen, waaronder calceïnekleurstof, lactaatoxidase (LOx)-enzym en ubiquitine (UQ)-eiwit, rechtstreeks in adhesieve cellen mogelijk voor de behandeling van kanker.
Een artikel waarin het onderzoek wordt beschreven, is gepubliceerd in Analytical Chemistry . Dit artikel is co-auteur van Dr. Tsutomu Mikawa, Dr. Masaomi Ikari, Dr. Hiromasa Yagi, Dr. Naoya Tochio en Dr. Takanori Kigawa van RIKEN Center for Biosystems Dynamics Research, Japan en de heer Bowen Zhang, de heer. Bingfu Liu, de heer Zhouji Wu en de heer Kazuhiro Oyama van de Waseda Universiteit, Japan.
Miyake legt kort de montage van het stempelsysteem uit. "De HyNT's werden gesynthetiseerd door middel van PEDOT-polymerisatie op Au-nanobuismembranen en vervolgens geassembleerd met een glazen buis om een stempel te creëren die HyNT's fysiek in cellen kan inbrengen."
De onderzoekers onderzochten het therapeutische potentieel van het leveren van LOx-enzym voor de behandeling van kanker. "Via ons innovatieve stempelsysteem hebben we met succes LOx afgeleverd in zowel gezonde mesenchymale stamcellen (MSC) als kankerachtige HeLa-cellen. Hoewel MSC-cellen onaangetast bleven, observeerden we significante celdood in HeLa-kankercellen na LOx-behandeling, waarbij de levensvatbaarheid in de loop van de tijd afnam.
"Onze bevindingen benadrukken de veelbelovende werkzaamheid van intracellulair afgeleverde LOx bij het selectief richten en doden van kankercellen, terwijl gezonde cellen worden gespaard, wat een gerichte therapeutische strategie voor de behandeling van kanker biedt", legt Miyake uit.
Uiteindelijk heeft het team met succes 15 opgeleverd N-isotoop-gelabelde UQ-eiwitten in HeLa-cellen met behulp van het HyNT-stempelsysteem. Deze levering maakte de analyse van complexe eiwitstructuren en interacties binnen de cellen mogelijk.
Bovendien bevestigde optische beeldvorming en fluorescentiebeeldvorming de aanwezigheid van afgeleverd UQ in HeLa-cellen, en nucleaire magnetische resonantiespectroscopie bracht de intracellulaire UQ-eiwitconcentratie overeen met die van een oplossing die 15 bevatte. N-gelabeld UQ.
Deze resultaten demonstreren de effectiviteit van het stempelsysteem bij het afleveren van doeleiwitten voor daaropvolgende analyse.
De resultaten demonstreren het opmerkelijke vermogen van het HyNT-stempelsysteem bij het afleveren van LOx en UQ in een aanzienlijk aantal adhesieve cellen, zoals vereist voor toepassingen in de regeneratieve geneeskunde.
Het systeem bereikte een opmerkelijk hoge toedieningsefficiëntie van 89,9%, wat aangeeft dat het effectief is bij het nauwkeurig transporteren van therapeutische eiwitten naar de doelcellen. Bovendien onderstreept het cellevensvatbaarheidspercentage van 97,1% het vermogen van het systeem om de gezondheid en integriteit van de behandelde cellen gedurende het hele leveringsproces te behouden.
Het HyNT-stempelsysteem biedt transformatief potentieel in de intracellulaire eiwitafgifte, met toepassingen variërend van kankerbehandeling tot moleculaire analyse. Naast de geneeskunde strekt de veelzijdigheid zich uit tot de landbouw- en voedingsindustrie, waarbij vooruitgang wordt beloofd op het gebied van de gewasproductie en de ontwikkeling van voedselproducten.
Met nauwkeurige celmanipulatie en efficiënte levering staat het HyNT-stempelsysteem klaar om een revolutie teweeg te brengen in het biomedisch onderzoek, de klinische praktijk en diverse industrieën, waardoor de weg wordt vrijgemaakt voor gepersonaliseerde interventies en de toekomst van de moderne geneeskunde vorm wordt gegeven.