
Wetenschap
Gemanipuleerde deeltjes produceren giftige stoffen die dodelijk zijn voor gerichte bacteriën
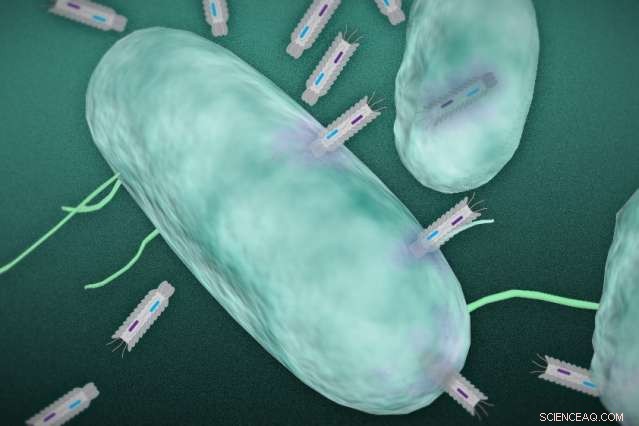
In deze illustratie, faagmide-plasmiden infecteren een gerichte bacterie. Credit:Christine Daniloff en Jose-Luis Olivares/MIT (plasmide-illustratie met dank aan de onderzoekers)
De wereldwijde toename van antibioticaresistentie vormt een groeiende bedreiging voor de volksgezondheid, ons vermogen om dodelijke infecties zoals tuberculose te bestrijden, aantasten.
Bovendien, inspanningen om nieuwe antibiotica te ontwikkelen geen gelijke tred houden met deze groei van microbiële resistentie, wat resulteert in een dringende behoefte aan nieuwe benaderingen om bacteriële infecties aan te pakken.
In een paper online gepubliceerd in het tijdschrift Nano-letters , onderzoekers van het MIT, het brede instituut van MIT en Harvard, en Harvard University onthullen dat ze een nieuwe manier hebben ontwikkeld om schadelijke bacteriën te doden.
De onderzoekers hebben deeltjes ontworpen, bekend als "fagemiden, " in staat om toxines te produceren die dodelijk zijn voor gerichte bacteriën.
Bacteriofagen - virussen die bacteriën infecteren en doden - worden al vele jaren gebruikt om infecties te behandelen in landen zoals die in de voormalige Sovjet-Unie. In tegenstelling tot traditionele breedspectrumantibiotica, deze virussen richten zich op specifieke bacteriën zonder de normale microflora van het lichaam te schaden.
Maar bacteriofagen kunnen ook potentieel schadelijke bijwerkingen veroorzaken, volgens James Collins, de Termeer-hoogleraar Medical Engineering and Science aan de afdeling Biological Engineering en het Institute of Medical Engineering and Science van het MIT, die het onderzoek leidde.
"Bacteriofagen doden bacteriën door de cel te lyseren, of het laten barsten, " zegt Collins. "Maar dit is problematisch, omdat het kan leiden tot het vrijkomen van vervelende gifstoffen uit de cel."
Deze toxines kunnen in sommige gevallen tot sepsis en zelfs de dood leiden, hij zegt.
Een zachtere uitbarsting
In eerder onderzoek is Collins en zijn collega's ontwikkelden bacteriofagen om eiwitten tot expressie te brengen die de cellen niet echt deden barsten, maar in plaats daarvan verhoogde de effectiviteit van antibiotica wanneer ze tegelijkertijd werden toegediend.
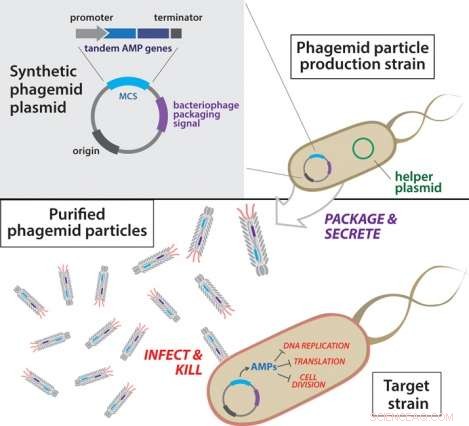
Overzicht van antibacteriële faagmideconstructie. Faagmideplasmiden worden eerst getransformeerd in een productiestam die een helperplasmide herbergt. Volgende, uitgescheiden faagmidedeeltjes worden uit de productiestam geïsoleerd en gezuiverd. De resulterende gemanipuleerde faagmidedeeltjes worden vervolgens gebruikt om doelbacteriën te infecteren.
Om voort te bouwen op dit eerdere werk, de onderzoekers wilden een verwante technologie ontwikkelen die gericht zou zijn op specifieke bacteriën en deze zou doden, zonder de cellen te laten barsten en hun inhoud vrij te geven.
De onderzoekers gebruikten technieken van synthetische biologie om een platform van deeltjes te ontwikkelen die fagemiden worden genoemd. Deze deeltjes infecteren bacteriën met kleine DNA-moleculen die bekend staan als plasmiden, die in staat zijn om onafhankelijk te repliceren in een gastheercel.
Eenmaal in de cel, de plasmiden zijn ontworpen om verschillende eiwitten of peptiden tot expressie te brengen - moleculen die bestaan uit korte ketens van aminozuren - die giftig zijn voor de bacteriën, zegt Collins.
"We hebben systematisch verschillende antimicrobiële peptiden en bacteriële toxines getest, en toonde aan dat wanneer je een aantal van deze combineert in de fagemiden, je kunt de overgrote meerderheid van de cellen in een cultuur doden, " hij zegt.
De tot expressie gebrachte toxines zijn ontworpen om verschillende cellulaire processen te verstoren, zoals bacteriële replicatie, waardoor de cel sterft zonder open te barsten.
Nauwkeurige targeting
De fagemiden zullen ook alleen een specifieke bacteriesoort infecteren, resulterend in een zeer gericht systeem, zegt Collins.
"Je kunt dit gebruiken om heel specifieke soorten bacteriën te doden als onderdeel van een infectietherapie, terwijl de rest van het microbioom gespaard blijft, " hij zegt.
Toen de onderzoekers de reactie van de bacteriën op herhaalde herinfectie met de fagemiden volgden, ze zagen geen tekenen van significante weerstand tegen de deeltjes. "Dit betekent dat je meerdere afleveringen van de fagemiden kunt doen, om een effectievere therapie te krijgen, " hij zegt.
Dit in tegenstelling tot herhaalde infectie met bacteriofagen, waar de onderzoekers ontdekten dat de bacteriën in de loop van de tijd resistentie ontwikkelden.
Hoewel Collins erkent dat bacteriën uiteindelijk weerstand zullen ontwikkelen tegen elke stress die op hen wordt uitgeoefend, het onderzoek suggereert dat het waarschijnlijk veel langer duurt voordat ze resistentie tegen faagmiden ontwikkelen dan tegen conventionele bacteriofaagtherapie, hij zegt.
Een "cocktail" van verschillende fagemiden zou aan patiënten kunnen worden gegeven om een niet-geclassificeerde infectie te behandelen, op een vergelijkbare manier als de breedspectrumantibiotica die tegenwoordig worden gebruikt.
Maar ze worden eerder gebruikt in combinatie met snelle diagnostische hulpmiddelen, momenteel in ontwikkeling, waarmee artsen specifieke infecties kunnen behandelen, zegt Collins. "U zou eerst een snelle diagnostische test uitvoeren om de bacteriën van uw patiënt te identificeren, en geef dan de juiste faagmide om de ziekteverwekker te doden, " hij zegt.
De onderzoekers zijn van plan hun platform uit te breiden door een breder scala aan fagemiden te ontwikkelen. Ze hebben tot nu toe geëxperimenteerd met een reeks fagemiden die specifiek zijn voor E. coli, maar hopen nu deeltjes te creëren die ziekteverwekkers zoals Clostridium difficile en de cholera-veroorzakende bacterie Vibrio cholerea kunnen doden.
Het artikel laat zien dat het gebruik van synthetische biologie om een gen in een faag te modificeren om het toxischer te maken voor een pathogeen, kan leiden tot effectievere antimicrobiële deeltjes dan klassieke benaderingen, zegt Alfonso Jaramillo, een professor in synthetische biologie aan de Universiteit van Warwick in het VK, die niet bij het onderzoek betrokken was.
"Het combineren van synthetische genetische apparaten met fagen als transportmiddelen maakt een systematische benadering mogelijk om pathogene bacteriën te herprogrammeren voor de dood, Jaramillo legt uit. "De focus van [onderzoekers] op niet-replicatieve fagen is ook zeer geschikt omdat die deeltjes beter geschikt zijn voor gebruik bij mensen, aangezien ze niet als genetisch gemodificeerde organismen worden beschouwd, " hij zegt.
De onderzoekers hebben een verbeterde vorm van faagtherapie ontwikkeld die mogelijk de antibiotica van de toekomst wordt. hij voegt toe.
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Optische parameters ontrafelen:nieuwe methode om plasmon-versterkte spectroscopie te optimaliseren
Optische parameters ontrafelen:nieuwe methode om plasmon-versterkte spectroscopie te optimaliseren CRISPR:Meer dan alleen voor het bewerken van genen?
CRISPR:Meer dan alleen voor het bewerken van genen? Een lage prijs, hoogrenderende katalysator die koolstofdioxide omzet in andere chemicaliën
Een lage prijs, hoogrenderende katalysator die koolstofdioxide omzet in andere chemicaliën Vloeistoffen tot het uiterste drijven met simulatiemethoden voor materialen van de volgende generatie
Vloeistoffen tot het uiterste drijven met simulatiemethoden voor materialen van de volgende generatie Een hardgekookt ei maken Ga naar een cola-fles
Een hardgekookt ei maken Ga naar een cola-fles
Hoofdlijnen
- Onderzoekers ontdekken dat twee verschillende ecologische mechanismen veerkracht kunnen bieden tegen invasieve soorten
- Philadelphia Zoo euthanaseert populaire Aziatische zwarte beer
- Alternatief voor cellulaire ademhaling
De productie van energie uit organische verbindingen, zoals glucose, door oxidatie met behulp van chemische (meestal organische) verbindingen uit een cel als "elektronenacceptoren" wordt fermentatie genoemd. D
- Trofisch niveau (voedselketen en web): definitie en voorbeelden (met diagram)
- Studie onthult hoe de adelborst zijn paar uur lang in stand houdt
- Getoonde chimpansees die spontaan om de beurt een cijferpuzzel oplossen
- Hoe een prokaryotisch celmodel te maken
- Welke drie organellen hebben DNA?
- Verbeteringen in de cryo-elektronenmicroscopie brengen het leven op atomair niveau duidelijker in beeld
- Gouden vehikel voor medicijnafgifte heeft verborgen kosten

- Kleine deeltjes, grote bevindingen:het maximaliseren van de energiewinst van kleine nanodeeltjes

- Nieuwe microscoop maakt bijna realtime video's van processen op nanoschaal

- Onderzoekers laten zien dat gepolymeriseerde nanokubussen complexe structuren vormen
- Geluidsgolven positioneren nanodraden nauwkeurig
 Bij hittenood, Griekenland voegt controles toe op branden, stroomstoringen
Bij hittenood, Griekenland voegt controles toe op branden, stroomstoringen Het voorspellen van droogte in het Amerikaanse Westen is nu nog moeilijker geworden
Het voorspellen van droogte in het Amerikaanse Westen is nu nog moeilijker geworden Schattingen van de stijgende zeespiegel vereisen een gezamenlijke reactie, deskundigen zeggen
Schattingen van de stijgende zeespiegel vereisen een gezamenlijke reactie, deskundigen zeggen Kleine implantaten voor cellen zijn functioneel in vivo
Kleine implantaten voor cellen zijn functioneel in vivo Heeft de toendra regen?
Heeft de toendra regen?  VS zegt dat sneeuwminnende lynx geen speciale bescherming meer nodig heeft
VS zegt dat sneeuwminnende lynx geen speciale bescherming meer nodig heeft Europa's oudste meer sporen 1,36 miljoen jaar klimaat
Europa's oudste meer sporen 1,36 miljoen jaar klimaat Onderzoekers visualiseren de motor van bacteriën in de eerste stap naar door mensen geproduceerde elektrische energie
Onderzoekers visualiseren de motor van bacteriën in de eerste stap naar door mensen geproduceerde elektrische energie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

