
Wetenschap
Liniaal op nanoschaal onthult de organisatie van het celmembraan
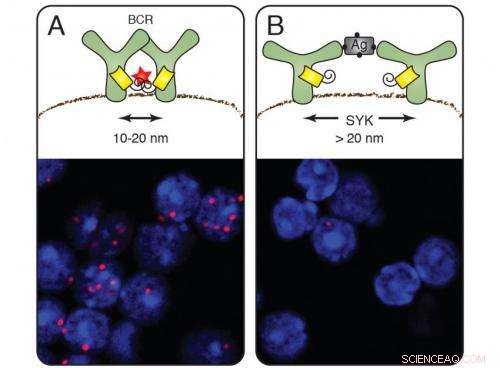
Op rustende cellen (A) vormen de B-cel-antigeenreceptoren groepen en de nanoliniaal zendt rode signalen uit (celkleuring hieronder). Na activering van de B-cellen door een antigeen verdwijnt het rode signaal (B). Het kinase Syk bemiddelt bij het openen van de receptor. Krediet:Michael Reth
Na een inspanning van tien jaar, Prof. Dr. Michael Reth van het Instituut voor Biologie III van de Universiteit van Freiburg en het Max Planck Instituut voor Immunobiologie en Epigenetica heeft een methode ontwikkeld om de organisatie van het celoppervlak op nanometerschaal te onderzoeken. Hierdoor kan hij volgen hoe de antigeenreceptor, welke B-cellen van het immuunsysteem gebruiken om vreemde stoffen te herkennen, verandert na activering. Deze studie toont aan dat de receptorcomponenten van elkaar dissociëren - in plaats van samen te voegen, zoals eerder werd aangenomen. Reorganisatie van receptoren op het celmembraan vindt plaats binnen een bereik van 10 tot 40 nanometer. Onder een optische microscoop, echter, het is alleen mogelijk om objecten te onderscheiden die minimaal 250 nanometer uit elkaar liggen.
Door gebruik te maken van antilichaamfragmenten, zogenaamde fab's, Reth, spreker van het cluster of excellence BIOSS Center for Biological Signalling Studies aan de Universiteit van Freiburg, en zijn team verbeterden de resolutie van de eerder ontwikkelde proximity ligation assay (PLA) ongeveer 10 keer.
Met deze technologie kunnen moleculen alleen worden gedetecteerd als ze zich dicht bij elkaar bevinden. Met behulp van de preciezere Fab-PLA-methode, de wetenschappers konden voor het eerst op een schaal van tien nanometer onderzoeken hoe receptoren op het membraan worden verdeeld en hoe ze worden gereorganiseerd. De Fab-PLA-methode is een belangrijk nieuw instrument voor het BIOSS Nanoscale Explorer Progamme (BiNEP), een van de onderzoeksfocussen van het Cluster of Excellence BIOSS Center for Biological Signalling Studies van de Universiteit van Freiburg.
Wanneer toegepast op de antigeenreceptoren, de Fab-PLA-methode onthulde rode fluorescerende stippen op het celmembraan van inactieve B-cellen:bewijs dat de antigeenreceptoren voor het eerst in groepen op het membraan verschijnen, zogenaamde receptorclusters. Zodra de B-cellen een antigeen ontdekten en geactiveerd werden, echter, de stippen verdwenen - de receptoren waren van elkaar verwijderd. Deze bevinding ondersteunt het dissociatiemodel van B-celactivering dat in 2010 werd voorgesteld door Michael Reth en Jianying Yang.
De onderzoekers toonden ook aan hoe de dissociatie plaatsvindt:ze verwijderden in B-cellen het gen dat codeert voor het signaalmolecuul Syk, een kinase dat nauw samenwerkt met de antigeenreceptor. Op B-cellen zonder Syk waren de receptorclusters nog aanwezig nadat ze het antigeen hadden gebonden. Syk is dus de moleculaire sleutel die het receptorcluster opent en de immuunrespons initieert. Om de verdere details van de activering van B-cellen op te helderen, de onderzoekers brachten Syk en de antigeenreceptorcomponenten in fruitvliegcellen. Ze wijzigden Syk en stelden vast dat het cluster niet wordt afgebroken totdat het molecuul is gebonden aan het binnenste deel van de antigeenreceptor.
De onderzoekers publiceerden hun bevindingen in het nieuwe open-access tijdschrift eLife . De studie omvatte ook een onderzoek naar de organisatie op nanoschaal van andere receptoren op B-cellen, inclusief het CD19- of CD20-molecuul. "We ontdekten dat veel receptoren op het membraan zijn georganiseerd in specifieke gebieden op nanoschaalniveau, " legt Kathrin Kläsener uit, Promovendus en hoofdauteur van de studie. Het onderzoek werd gedeeltelijk gefinancierd door een Advanced Grant voor nanoschaalanalyse van eiwiteilanden op lymfocyten van de European Research Council (ERC), die Reth in 2012 ontving.
 Op heterdaad betrapt:beelden leggen moleculaire bewegingen in realtime vast
Op heterdaad betrapt:beelden leggen moleculaire bewegingen in realtime vast Polyethyleen brandvertragend maken
Polyethyleen brandvertragend maken Team ontdekt dat polymorfe selectie tijdens kristalgroei thermodynamisch kan worden aangestuurd
Team ontdekt dat polymorfe selectie tijdens kristalgroei thermodynamisch kan worden aangestuurd UNT's moderne alchemist zet eerste stappen om methaan om te zetten in methanol
UNT's moderne alchemist zet eerste stappen om methaan om te zetten in methanol Wetenschappers kijken naar vetmetabolisme in levende vissen, observeer real-time lipidenbiochemie
Wetenschappers kijken naar vetmetabolisme in levende vissen, observeer real-time lipidenbiochemie
 Canarische vulkaanlava bereikt zee, angst voor giftig gas opwekken
Canarische vulkaanlava bereikt zee, angst voor giftig gas opwekken Vrij verkeer kan mensen beschermen tegen milieubedreigingen
Vrij verkeer kan mensen beschermen tegen milieubedreigingen Branden in Californië brengen meer reddingen met helikopters, stroomuitschakelingen
Branden in Californië brengen meer reddingen met helikopters, stroomuitschakelingen Het verlies van plantengemeenschappen aan de kust door klimaatverandering zal de zeewering verzwakken
Het verlies van plantengemeenschappen aan de kust door klimaatverandering zal de zeewering verzwakken Een harde regen in Australië met klimaatverandering
Een harde regen in Australië met klimaatverandering
Hoofdlijnen
- Drie mechanismen van genetische recombinatie in Prokaryotes
- Bijenschadelijke pesticiden in 75 procent van de honing wereldwijd:studie
- What Influences Phenotype?
- Hoe water door planten beweegt
- Een universele voedsel- en alarmsignaal gevonden in zoogdierbloed
- Een sociaal controlesysteem garandeert de zuiverheid van embryonale stamcellen
- Zooplankton Vs. fytoplankton
- Deze spitsmuizen hebben koppen die krimpen met het seizoen
- Golgi-apparaat: functie, structuur (met analogie en diagram)
- Onderzoekers vinden oranje met mangaan gedoteerde kwantumstippen die uit vele kleuren bestaan

- Gouden nanolijm maakt het wondermateriaal compleet

- Onderzoekers vermommen medicijnen als bloedplaatjes om kanker te bestrijden
- Elektrochemische prestaties van lithium-ioncondensatoren met behulp van voorgelithieerde meerwandige koolstofnanobuizen als anode

- Een duurzaam en recyclebaar thermo-elektrisch papier

 Nieuwe toepassingen vinden voor afvalbanden
Nieuwe toepassingen vinden voor afvalbanden Muziekbusiness groeit in recordtempo terwijl digitaal domineert
Muziekbusiness groeit in recordtempo terwijl digitaal domineert Onderzoeker onthult schade door anderen te vernederen
Onderzoeker onthult schade door anderen te vernederen Kenmerken van Intrusive Rocks
Kenmerken van Intrusive Rocks Gebruik van trigonometrie in architectuur
Gebruik van trigonometrie in architectuur Solar Ring-missie:een nieuw concept van ruimteverkenning om de zon en de innerlijke heliosfeer te begrijpen
Solar Ring-missie:een nieuw concept van ruimteverkenning om de zon en de innerlijke heliosfeer te begrijpen Wetenschappers maken vloeibare kristallen die veel op hun vaste tegenhangers lijken
Wetenschappers maken vloeibare kristallen die veel op hun vaste tegenhangers lijken Voordelen van een PCB Board
Voordelen van een PCB Board
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Swedish | German | Dutch | Norway | Spanish | Portuguese | Danish |

-
Wetenschap © https://nl.scienceaq.com

