Wetenschap
Nieuwe microscopietechniek biedt close-up, realtime weergave van cellulaire verschijnselen
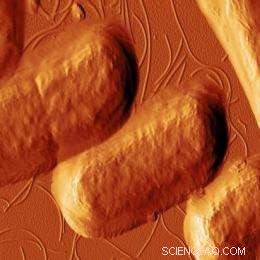
Deze afbeelding, genomen met atoomkrachtmicroscopie, toont E. coli-bacteriën nadat ze zijn blootgesteld aan het antimicrobiële peptide CM15. De peptiden zijn begonnen met het vernietigen van de celwanden van de bacteriën. Afbeelding:Georg Fantner
Gedurende twee decennia, wetenschappers hebben gezocht naar een mogelijke nieuwe manier om bacteriële infecties te behandelen, met behulp van natuurlijk voorkomende eiwitten die bekend staan als antimicrobiële peptiden (AMP's). Nutsvoorzieningen, MIT-wetenschappers hebben de eerste microscopische beelden opgenomen die de dodelijke effecten van AMP's laten zien, waarvan de meeste doden door gaten in bacteriële celmembranen te prikken.
Onderzoekers onder leiding van MIT-professor Angela Belcher hebben een bestaande, uiterst gevoelige techniek die bekend staat als high-speed atomic force microscopy (AFM) om de bacteriën in realtime in beeld te brengen. hun methode, beschreven in de online editie van 14 maart van Natuur Nanotechnologie , is de eerste manier om levende cellen te bestuderen met behulp van beelden met een hoge resolutie die snel achter elkaar zijn opgenomen.
Door dit type snelle AFM te gebruiken, kunnen wetenschappers bestuderen hoe cellen reageren op andere medicijnen en op virale infecties, zegt Belcher, de Germeshausen Professor of Materials Science and Engineering en Biological Engineering en een lid van het Koch Institute for Integrative Cancer Research aan het MIT.
Het kan ook nuttig zijn bij het bestuderen van celdood in zoogdiercellen, zoals de zenuwceldood die optreedt bij Alzheimerpatiënten, zegt Paul Hansma, een natuurkundeprofessor aan de Universiteit van Californië in Santa Barbara die al 20 jaar AFM-technologie ontwikkelt. "Dit artikel is een zeer belangrijke vooruitgang in de state-of-the-art beeldvorming van cellulaire processen, ’ zegt Hansma, die niet bij het onderzoek betrokken was.
Hoge snelheid
Atoomkrachtmicroscopie, uitgevonden in 1986, wordt veel gebruikt om materialen op nanoschaal af te beelden. De resolutie (ongeveer 5 nanometer) is vergelijkbaar met die van elektronenmicroscopie, maar in tegenstelling tot elektronenmicroscopie, het vereist geen vacuüm en kan dus worden gebruikt met levende monsters. Echter, traditionele AFM heeft enkele minuten nodig om één beeld te maken, dus het kan geen opeenvolging van snel optredende gebeurtenissen registreren.
In recente jaren, wetenschappers hebben snelle AFM-technieken ontwikkeld, maar heb ze niet geoptimaliseerd voor levende cellen. Dat is wat het MIT-team wilde doen, voortbouwend op de ervaring van hoofdauteur Georg Fantner, een postdoctoraal medewerker in het laboratorium van Belcher die had gewerkt aan snelle AFM aan de Universiteit van Californië in Santa Barbara.
Atoomkrachtmicroscopie maakt gebruik van een cantilever die is uitgerust met een sondepunt die het oppervlak van een monster "voelt". Krachten tussen de punt en het monster kunnen worden gemeten terwijl de sonde over het monster beweegt, het onthullen van de vorm van het oppervlak. Het MIT-team gebruikte een cantilever van ongeveer 1, 000 keer kleiner dan normaal voor de AFM, waardoor ze de beeldsnelheid konden verhogen zonder de bacteriën te schaden.
De metingen worden uitgevoerd in een vloeibare omgeving, een andere kritische factor om de bacteriën in leven te houden.
Met de nieuwe opstelling het team was in staat om elke 13 seconden beelden te maken gedurende een periode van enkele minuten na behandeling met een AMP die bekend staat als CM15. Ze ontdekten dat door AMP geïnduceerde celdood een proces in twee stappen lijkt te zijn:een korte incubatieperiode gevolgd door een snelle "uitvoering". Ze waren verrast om te zien dat het begin van de incubatietijd varieerde van 13 tot 80 seconden.
“Niet alle cellen begonnen op exact hetzelfde moment te sterven, hoewel ze genetisch identiek waren en tegelijkertijd aan het peptide werden blootgesteld, " zegt Roberto Barbero, een afgestudeerde student in biologische technologie en een auteur van het papier.
De meeste AMP's werken door bacteriële celmembranen te doorboren, die het delicate evenwicht tussen de bacterie en zijn omgeving vernietigt. Anderen lijken zich te richten op machines in de cel. Er is veel belangstelling geweest voor de ontwikkeling van AMP's als medicijnen die traditionele antibiotica kunnen aanvullen of vervangen, maar nog geen enkele is goedgekeurd.
Tot een paar jaar geleden, men dacht dat bacteriën niet resistent konden worden tegen AMPS, maar recente studies hebben aangetoond dat ze dat kunnen. Het nieuwe MIT-werk zou onderzoekers kunnen helpen begrijpen hoe die resistentie zich ontwikkelt.
 Objecten printen die levende organismen kunnen bevatten
Objecten printen die levende organismen kunnen bevatten Dennennaalden van oude kerstbomen kunnen in de toekomst worden omgezet in verf en voedselzoetstoffen
Dennennaalden van oude kerstbomen kunnen in de toekomst worden omgezet in verf en voedselzoetstoffen Fosforescerend materiaal geïnspireerd op glow in the dark hout
Fosforescerend materiaal geïnspireerd op glow in the dark hout Watersplitsing stimuleren om chemische brandstoffen te maken
Watersplitsing stimuleren om chemische brandstoffen te maken Hoe elektronen-puntdiagrammen te tekenen
Hoe elektronen-puntdiagrammen te tekenen
 Onderzoekers:zet een rem op bio-energie tegen 2050 om negatieve klimaateffecten te voorkomen
Onderzoekers:zet een rem op bio-energie tegen 2050 om negatieve klimaateffecten te voorkomen Gehavende Caraïben bereidt zich voor op orkanen te midden van pandemie
Gehavende Caraïben bereidt zich voor op orkanen te midden van pandemie Spookvisuitrusting:het afval dat de oceaan in het wild achtervolgt
Spookvisuitrusting:het afval dat de oceaan in het wild achtervolgt Verloren bomen enorm overschat als bedreiging voor het milieu, studie vondsten
Verloren bomen enorm overschat als bedreiging voor het milieu, studie vondsten Menselijk afval een aanwinst voor de economie, omgeving, studie vondsten
Menselijk afval een aanwinst voor de economie, omgeving, studie vondsten
Hoofdlijnen
- Lijst van eencellige organismen
- Hoe communiceren bacteriën?
- Iraakse dierenliefhebbers gaan online om zwerfdieren in Bagdad te redden
- Wat is de meest logische volgorde van stappen voor het splitsen van vreemd DNA?
- Wat zijn de functies van glasplaat & dekglaasjes?
- Microbieel ecosysteem bij Laguna La Brava kan nieuwe micro-organismen bevatten
- Wat is een Mordant in de microbiologie?
- El Nino in de Stille Oceaan heeft invloed op dolfijnen in West-Australië
- Lijst met genotypes
 China meldt geen grote instortingen na krachtige aardbeving
China meldt geen grote instortingen na krachtige aardbeving Techniek verdubbelt conversie van CO2 naar plastic component
Techniek verdubbelt conversie van CO2 naar plastic component Hoe een cent te roesten
Hoe een cent te roesten  Gecontroleerde verwarming van gouden nanodeeltjes
Gecontroleerde verwarming van gouden nanodeeltjes Hoe een incubator werkt
Hoe een incubator werkt NASA simuleert asteroïde-inslagen om mogelijke levensbedreigende gebeurtenissen te helpen identificeren
NASA simuleert asteroïde-inslagen om mogelijke levensbedreigende gebeurtenissen te helpen identificeren Polymere kristallen maken
Polymere kristallen maken Kunnen mensen een vulkaanuitbarsting forceren?
Kunnen mensen een vulkaanuitbarsting forceren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com