
Wetenschap
Wat zijn de krachten die elk type kristallijne vaste stof bij elkaar houden?
1. Ionische vaste stoffen
* Force: Elektrostatische aantrekkingskracht (ionische bindingen) tussen tegengesteld geladen ionen.
* kenmerken: Hoge smeltpunten, harde, brosse, goede elektrische geleiders wanneer ze worden gesmolten of opgelost.
* Voorbeelden: NaCl (tafelzout), mgo (magnesiumoxide), caco3 (calciumcarbonaat)
2. Covalente netwerk Solids
* Force: Sterke covalente bindingen die zich uitstrekken over het gehele kristalrooster.
* kenmerken: Zeer hoge smeltpunten, extreem harde, slechte elektrische geleiders.
* Voorbeelden: Diamond (c), siliciumcarbide (sic), kwarts (SiO2)
3. Metalen vaste stoffen
* Force: Metallische binding, waarbij elektronen worden gedelokaliseerd en gedeeld door het kristalrooster.
* kenmerken: Hoge elektrische geleidbaarheid, kneedbaar, ductiel, vaak glanzend.
* Voorbeelden: Goud (au), koper (cu), ijzer (fe), aluminium (al)
4. Moleculaire vaste stoffen
* Force: Zwakke intermoleculaire krachten (van der Waals -krachten, waterstofbinding) tussen moleculen.
* kenmerken: Lage smeltpunten, zachte, slechte elektrische geleiders.
* Voorbeelden: Ice (H2O), droogijs (CO2), jodium (I2)
5. Waterstofgebonden vaste stoffen
* Force: Sterke dipool-dipoolinteracties, met name waterstofbinding.
* kenmerken: Relatief hoge smeltpunten, vaak hard en bros, goede oplosbaarheid in polaire oplosmiddelen.
* Voorbeelden: ICE (H2O), DNA, eiwitten
Hier is een tabel die de belangrijkste verschillen samenvat:
| Type solide | Bonding Force | Smeltpunt | Hardheid | Elektrische geleidbaarheid | Voorbeelden |
| --- | --- | --- | --- | --- | --- |
| Ionic | Elektrostatische attractie | Hoog | Hard, bros | Goed (wanneer gesmolten/opgelost) | NaCl, MGO, Caco3 |
| Covalent Network | Covalente bindingen | Zeer hoog | Heel moeilijk | Slecht | Diamond, sic, SiO2 |
| Metallic | Metallic binding | Hoog | Makable, ductile | Goed | Goud, koper, ijzer, aluminium |
| Moleculair | Intermoleculaire krachten | Laag | Zacht | Slecht | IJs, droog ijs, jodium |
| Waterstofgebonden | Waterstofbinding | Relatief hoog | Hard, bros | Slecht | Ice, DNA, eiwitten |
belangrijke opmerkingen:
* Bindingsterkte: De sterkte van de krachten die een vaste stof bij elkaar houden, heeft direct invloed op zijn eigenschappen. Sterkere krachten leiden tot hogere smeltpunten, grotere hardheid, enzovoort.
* variaties binnen typen: Er kunnen variaties zijn binnen elk type vaste stof. Sommige moleculaire vaste stoffen worden bijvoorbeeld sterker bij elkaar gehouden dan andere, wat resulteert in verschillen in smeltpunt en hardheid.
 Waarom is het mogelijk dat een zuurstofatoom een dubbele covalente binding vormt, maar geen chloorbinding?
Waarom is het mogelijk dat een zuurstofatoom een dubbele covalente binding vormt, maar geen chloorbinding?  Waarom reageren alkanen niet met broomwater?
Waarom reageren alkanen niet met broomwater?  Wat is rutherfordiums atomaire massa?
Wat is rutherfordiums atomaire massa?  Hoeveel gedegenereerde orbitalen zijn er nodig om zeven elektronen met vijf o te bevatten?
Hoeveel gedegenereerde orbitalen zijn er nodig om zeven elektronen met vijf o te bevatten?  Als de concentratie van een waterige oplossing afneemt, zal de resulterende oplossingen de geleidbaarheid toenemen of afnemen?
Als de concentratie van een waterige oplossing afneemt, zal de resulterende oplossingen de geleidbaarheid toenemen of afnemen?
 NASA vindt kleine overblijfselen van tropische cycloon Owen
NASA vindt kleine overblijfselen van tropische cycloon Owen Irmas zware regenval gemeten door NASA's IMERG
Irmas zware regenval gemeten door NASA's IMERG Over milieubescherming, Bidens-verkiezing betekent een ommezwaai van 180 graden van het beleid van Trump
Over milieubescherming, Bidens-verkiezing betekent een ommezwaai van 180 graden van het beleid van Trump Langs een rivier in Minnesota, ijs en snoekbaarzen signaleren een veranderend klimaat
Langs een rivier in Minnesota, ijs en snoekbaarzen signaleren een veranderend klimaat Minder voedselverspilling in Zuid-Afrika dan in Europa
Minder voedselverspilling in Zuid-Afrika dan in Europa
Hoofdlijnen
- Wetenschappers ontdekken hoe belangrijke eiwitten essentiële genetische informatie scheiden tijdens mitose
- Hoe zijn de Europese zoetwatervissoorten in de loop van de tijd veranderd?
- Is het mogelijk dat wat micro -organisme twee geslachten heeft?
- Is menselijk brein een levend organisme?
- Populaire sportvissen vertonen gedragsstoornissen door blootstelling aan ruwe olie, zo blijkt uit onderzoek
- Wat zijn 25 organismen waaruit een Web in Oceanic Food bestaat?
- Wat doen eiwitten in de mitochondriën?
- Cellen uit de vroege aarde zijn gemodelleerd om te laten zien hoe eerste levensvormen RNA zouden kunnen hebben verpakt
- Wat is wetenschapper in het Hindi?
- Nieuwe gegevens om te begrijpen hoe zwaardere elementen in de kosmos worden gemaakt

- Snelle beeldvorming van korrelige materie
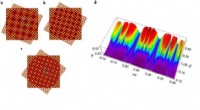
- Moiré-roosters die worden gebruikt om de vorming van optische solitonen te induceren
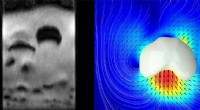
- Een supergeleider die zijn elektronische ladingsrangschikking onthoudt
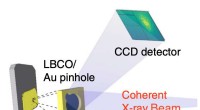
- Magnesiumdiboride in bulk supergeleidend houden bij hogere stroomdichtheden

 Onderzoek in Rusland daagt het wijdverbreide begrip van de klimaatgeschiedenis uit het verleden uit
Onderzoek in Rusland daagt het wijdverbreide begrip van de klimaatgeschiedenis uit het verleden uit Is de aarde één grote rots?
Is de aarde één grote rots?  Is de oorspronkelijke energiebron voor zonne -brandstoffen?
Is de oorspronkelijke energiebron voor zonne -brandstoffen?  Verschil tussen homozygoot en heterozygoot
Verschil tussen homozygoot en heterozygoot Hoe ver van de aarde is de Constellation Scorpius?
Hoe ver van de aarde is de Constellation Scorpius?  Was Edmund Halley de ontdekker van Comet?
Was Edmund Halley de ontdekker van Comet?  Wat zijn gematigde klimaatkenmerken?
Wat zijn gematigde klimaatkenmerken?  We schatten dat er tot 14 miljoen ton microplastics op de zeebodem ligt. Het is erger dan we dachten
We schatten dat er tot 14 miljoen ton microplastics op de zeebodem ligt. Het is erger dan we dachten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

