
Wetenschap
Wat is een factor bij het bepalen van de gemiddelde atoommassa van een element?
Dit is waarom:
* isotopen: Atomen van hetzelfde element kunnen verschillende aantallen neutronen hebben, wat leidt tot verschillende atoommassa's. Deze variaties worden isotopen genoemd.
* overvloed: Elke isotoop bestaat in een specifiek percentage van aard.
* gewogen gemiddelde: De gemiddelde atoommassa wordt berekend door een gewogen gemiddelde van de massa's van alle isotopen van een element te nemen. Het gewicht dat aan elke isotoop is toegewezen, is de natuurlijke overvloed.
Voorbeeld:
* Koolstof heeft twee hoofdisotopen:koolstof-12 (overvloed =98,9%) en koolstof-13 (overvloed =1,1%).
* Carbon-12 heeft een massa van 12 AMU en koolstof-13 heeft een massa van 13 AMU.
* De gemiddelde koolstofmassa wordt berekend als:
* (0.989 x 12 AMU) + (0,011 x 13 AMU) =12.01 AMU
Daarom speelt de overvloed van elke isotoop een cruciale rol bij het bepalen van de gemiddelde atoommassa van een element.
Hoofdlijnen
- Is het waar dat wanneer cellen naar hogere organisatieniveaus gaan in een organisme, ze moeten werken met minder verschillende soorten cellen?
- Zijn de meeste dierengameten diploïde of haploïde?
- Waarom is het hoornvlies helder?
- Kun je verslaafd zijn aan endorfine?
- Stijgende zeetemperaturen bedreigen Atlantische populaties van Bulwers-stormvogels
- Hoe behoudt een meercellulair organisme homeostase?
- Waar is mensenhaar van gemaakt?
- Wat doen wetenschappers als hun hypothesen correct zijn?
- Nieuw onderzoek laat zien hoe de genfunctie de natuurlijke selectie in een belangrijke klasse van genetische elementen aandrijft
- Methode gevonden om fotonen elkaar af te stoten in een ultrakoud atomair gas
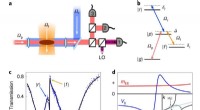
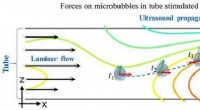
- Geluidsgolven gebruiken om medicijnen op afstand op tumoren te richten
- Nieuwe tool voor machine learning diagnosticeert elektronenstralen op een efficiënte, niet-invasieve manier

- Op diamanten gebaseerde sensoren maken spintronica en MRI van de volgende generatie mogelijk

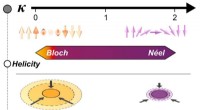
- Ontgrendeling van het recept voor magnetische designerdeeltjes voor de volgende generatie computertechnologieën
 Wetenschappers onthullen voor het eerst het exacte proces waarmee chaotische systemen synchroniseren
Wetenschappers onthullen voor het eerst het exacte proces waarmee chaotische systemen synchroniseren De juiste vrouwen voor de job
De juiste vrouwen voor de job Tweede wetenschappelijke ballon gelanceerd vanaf Antarctica
Tweede wetenschappelijke ballon gelanceerd vanaf Antarctica Het inpakken van koperen kubussen van nanoformaat kan helpen om koolstofdioxide om te zetten in andere chemicaliën
Het inpakken van koperen kubussen van nanoformaat kan helpen om koolstofdioxide om te zetten in andere chemicaliën Bladsensoren kunnen boeren vertellen wanneer gewassen moeten worden bewaterd
Bladsensoren kunnen boeren vertellen wanneer gewassen moeten worden bewaterd Poeder, geen gas:een veiliger, effectievere manier om een ster op aarde te creëren
Poeder, geen gas:een veiliger, effectievere manier om een ster op aarde te creëren Een betere hiv-test
Een betere hiv-test Wat is het huidige wetenschappelijke begrip van anti-donkere materie en de mogelijke implicaties ervan voor ons universum?
Wat is het huidige wetenschappelijke begrip van anti-donkere materie en de mogelijke implicaties ervan voor ons universum?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


