
Wetenschap
Welke banen kunnen elektronen innemen?
```
r =n^2 * h^2 / (2 * pi * m * k * e^2)
```
waar:
* r is de straal van de baan in meters
* n is het belangrijkste kwantumgetal, dat elke positieve gehele waarde kan aannemen
* h is de constante van Planck (6,626 x 10^-34 J s)
* m is de massa van het elektron (9,11 x 10^-31 kg)
* k is de Coulomb-constante (8,99 x 10^9 N m^2/C^2)
* e is de elementaire lading (1,602 x 10^-19 C)
De energie van een elektron in een baan wordt gegeven door de formule:
```
E =-13,6 eV / n^2
```
waar:
* E is de energie van het elektron in elektronvolt (eV)
* n is het belangrijkste kwantumgetal
Naarmate het hoofdkwantumgetal n toeneemt, neemt de straal van de baan toe en neemt de energie van het elektron af. De baan met de laagste energie is de baan n =1, die de K-schil wordt genoemd. De volgende energiebaan is de n =2-baan, die de L-schil wordt genoemd. En zo verder.
Elk elektron in een atoom neemt een specifieke orbitaal in beslag, die wordt gedefinieerd door de drie kwantumgetallen:het hoofdkwantumgetal n, het impulsmomentumgetal l en het magnetische kwantumgetal m. Het n-kwantumgetal bepaalt de energie van de orbitaal, het l-kwantumgetal bepaalt de vorm van de orbitaal, en het m-kwantumgetal bepaalt de oriëntatie van de orbitaal in de ruimte.
De elektronen in een atoom vullen de orbitalen in een specifieke volgorde, het zogenaamde Aufbau-principe. De orbitalen met de laagste energie worden eerst gevuld, en daarna gaan de elektronen naar orbitalen met hogere energie naarmate het atoom complexer wordt.
De elektronenconfiguratie van een atoom is een beschrijving van het aantal en de rangschikking van elektronen in de orbitalen van het atoom. De elektronenconfiguratie kan worden gebruikt om de chemische eigenschappen van het atoom te voorspellen.
 Een filament dat geschikt is voor de ruimte - het is bewezen dat zijde gedijt bij temperaturen in de ruimte
Een filament dat geschikt is voor de ruimte - het is bewezen dat zijde gedijt bij temperaturen in de ruimte Betere thermo-elektrische eigenschappen bereikt in n-type composiet
Betere thermo-elektrische eigenschappen bereikt in n-type composiet Hoe nieuwe materialen de efficiëntie van directe ethanolbrandstofcellen verhogen
Hoe nieuwe materialen de efficiëntie van directe ethanolbrandstofcellen verhogen Tweewaardig goudcomplex voor het eerst geïsoleerd in zuivere vorm
Tweewaardig goudcomplex voor het eerst geïsoleerd in zuivere vorm Wat zijn slechte dingen aan scheikunde?
Wat zijn slechte dingen aan scheikunde?
 Olifanten weten wat het betekent om te wijzen, er is geen training voor nodig
Olifanten weten wat het betekent om te wijzen, er is geen training voor nodig  Afbeelding:NASA ziet de aswolk van Mount Agungs boven de Balizee
Afbeelding:NASA ziet de aswolk van Mount Agungs boven de Balizee Hoe oceanen en atmosferen warmte verplaatsen op aarde en andere planetaire lichamen
Hoe oceanen en atmosferen warmte verplaatsen op aarde en andere planetaire lichamen Waarom is het opvangen van restwarmte belangrijk?
Waarom is het opvangen van restwarmte belangrijk?  Chocolade-industrie stimuleert ontbossing van Ivoorkust:rapport
Chocolade-industrie stimuleert ontbossing van Ivoorkust:rapport
Hoofdlijnen
- Welke wetenschapper zou hoogstwaarschijnlijk de vroegere biosfeer bestuderen?
- Vis uit het water:hoe killifish-embryo's hun ontwikkeling aanpassen
- Welke moleculen kunnen zonder hulp door het plasmamembraan gaan?
- Wat gebeurt er met een plantencel in een zoutoplossing?
- Onthulling van de ingewikkelde en subtiele dans van eiwitten:begrijpen hoe parasieten de verdediging van de gastheer ontwapenen
- Waarom doden we?
- Slangen doen het sneller en beter:hoe een groep geschubde, pootloze hagedissen de evolutionaire jackpot won
- Als GGO-genen ontsnappen, hoe zullen de hybriden het dan doen?
- Hoe verhoudt DNA-forensisch onderzoek zich tot biologie?
- Innovatieve microscoop klaar om optogenetische studies voort te stuwen

- Onderzoekers schijnen licht op de defecten die verantwoordelijk zijn voor rommelig gedrag in kwantummaterialen

- Gemarineerde eieren gebruiken om diffusie aan te tonen
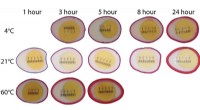
- Onderzoekers ontwikkelen nieuwe techniek voor het vervaardigen van lenzen

- Natuurkundigen demonstreren het bestaan van een nieuwe subatomaire structuur

 Wat is een ander woord dat zonne-energie gebruikt, maar geen systeem?
Wat is een ander woord dat zonne-energie gebruikt, maar geen systeem?  Een nieuwe methode voor de behandeling van stikstofhoudend afvalwater met een hoog zoutgehalte
Een nieuwe methode voor de behandeling van stikstofhoudend afvalwater met een hoog zoutgehalte Een verborgen bron van luchtvervuiling? Je dagelijkse huishoudelijke taken
Een verborgen bron van luchtvervuiling? Je dagelijkse huishoudelijke taken  Ringvormige multi-koolstofverbinding cyclocarbon gesynthetiseerd
Ringvormige multi-koolstofverbinding cyclocarbon gesynthetiseerd Seleniumankers kunnen de duurzaamheid van platinabrandstofcelkatalysatoren verbeteren
Seleniumankers kunnen de duurzaamheid van platinabrandstofcelkatalysatoren verbeteren Water op de maan?
Water op de maan?  Franse aardbevingsfout in kaart gebracht
Franse aardbevingsfout in kaart gebracht Zwarte wolven:de eerste genetisch gemodificeerde roofdieren?
Zwarte wolven:de eerste genetisch gemodificeerde roofdieren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

