
Wetenschap
Lichtmicroscopie biedt een diep inzicht in de eiwitstructuur
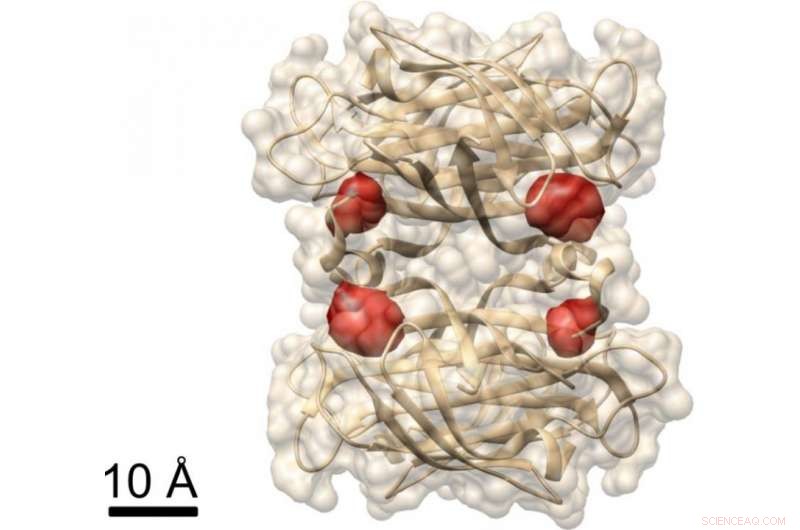
Aanzicht van een eiwit:Max Planck-onderzoekers hebben de COLD-methode gebruikt om de vier bindingsplaatsen van biotine (gelabeld door rode kleurstofmoleculen) in het eiwit streptavidine te visualiseren, waarvan de structuur al bekend is. Krediet:MPI voor de wetenschap van het licht
Lichtmicroscopie blijft de microscopische wereld onthullen met een steeds grotere resolutie. Met behulp van een nieuwe methode genaamd KOUD, wetenschappers van het Max Planck Institute for the Science of Light in Erlangen hebben nu eiwitstructuren gevisualiseerd met een resolutie van ongeveer 5 Å. COLD bereikt deze ongekende resolutie door te werken bij een temperatuur van min 270 graden Celsius. Bij zulke lage temperaturen de signalen van fluorescerende eiwitten kunnen nauwkeuriger worden gelokaliseerd. De methode opent daardoor de mogelijkheid lage temperaturen, de signalen van fluorescerende eiwitten kunnen nauwkeuriger worden gelokaliseerd. De methode opent daarmee de mogelijkheid om structurele veranderingen van eiwitten die met specifieke ziekten zijn geassocieerd, waar te nemen.
Tot het einde van de 20e eeuw, lichtmicroscopen waren onderhevig aan een belangrijke beperking:hun resolutie werd beperkt door het golfkarakter van licht. Al in 1873, de natuurkundige Ernst Abbe formuleerde een wet die, in vereenvoudigde termen, stelt dat een optische microscoop geen structuren kan oplossen die kleiner zijn dan de helft van de golflengte van zichtbaar licht - ongeveer 200 nanometer. "Dit komt overeen met een keten van enkele duizenden atomen, " legt Vahid Sandoghdar uit, Directeur van het Max Planck Institute for the Science of Light.
Deze limiet werd als onoverkomelijk beschouwd, totdat onderzoekers superresolutie-fluorescentiemicroscopiemethoden ontwikkelden, zoals STED en PALM/STORM, in de afgelopen twee decennia. Deze technieken verbeterden de optische resolutie tot ongeveer 20 tot 30 nanometer. In 2014, de wetenschappers die betrokken zijn bij die uitvindingen, waaronder Stefan Hell van het Max Planck Instituut voor Biofysische Chemie in Göttingen, kregen de Nobelprijs voor Scheikunde. Onlangs, een team onder leiding van Hell verhoogde de resolutielimiet met nog eens twintig keer met behulp van een nieuw ontwikkelde microscopietechniek die bekend staat als MINFLUX. De resolutie van deze methode was voldoende om naburige moleculen te onderscheiden die slechts enkele nanometers van elkaar verwijderd zijn.
KOUD laat een glimp toe van individuele eiwitmoleculen
Vahid Sandoghdar en zijn collega's werken al enkele jaren aan alternatieve methoden om de prestaties van fluorescentiemicroscopie met hoge resolutie te verbeteren - met aanzienlijk succes, zoals de fysicus van Erlangen meldt:"Onze nieuwe benadering stelt ons in staat om structuren weer te geven die gescheiden zijn door een afstand van minder dan vijf angstrom, oftewel een halve nanometer. We kunnen daardoor in eiwitmoleculen kijken." Sandoghdar en zijn collega's presenteerden in 2013 voor het eerst het basisconcept. die ze COLD hebben bedacht voor cryogene optische lokalisatie in drie dimensies. De naam COLD zegt het al:"Het belangrijkste aan COLD is de lage temperatuur waarbij de metingen plaatsvinden, ongeveer min 270 graden Celsius, ' zegt de fysicus.
Het basisprincipe van fluorescentiebeeldvorming is hetzelfde voor alle microscopen:het monster wordt eerst chemisch gelabeld met fluorescerende moleculen die fluoroforen worden genoemd. Hierdoor worden bepaalde gebieden of componenten van het monster, bijv. cellen, zichtbaar. Echter, conventionele technieken worden beperkt door de Abbe-limiet. Wanneer meerdere dicht bij elkaar gelegen fluoroforen tegelijkertijd licht uitstralen, hun signalen overlappen elkaar en kunnen niet meer als afzonderlijke punten worden herkend. De superresolutiemethoden, daarentegen, zijn in staat om de fluorescerende vlekmoleculen aan en uit te zetten. Dit maakt het mogelijk om de positie van elk met een relatief hoge mate van precisie te bepalen. Echter, de precisie lijdt onder statistische ruis:hoe korter de fluoroforen licht uitstralen, hoe groter de onnauwkeurigheid. En meestal lichten ze maar heel kort op, omdat door licht geïnduceerde chemische processen het molecuul bleken.
Moleculen kunnen nauwkeuriger worden gelokaliseerd bij lage temperaturen
Dit is waar COLD in het spel komt. De extreem lage temperaturen vertragen de fotobleking enorm, zodat elke fluorofoor aanzienlijk langer oplicht. "Dit vermindert ruis op de afbeeldingen en verbetert de lokalisatienauwkeurigheid, " zegt Siegfried Weisenburger, die de experimenten uitvoerde als onderdeel van zijn promotieonderzoek op de afdeling van Sandoghdar.
In samenwerking met Christian Griesinger en zijn afdeling van het Max Planck Instituut voor Biofysische Chemie in Göttingen, de wetenschappers van Erlangen konden hun techniek gebruiken voor het oplossen van twee fluoroforen op een eiwit dat slechts één nanometer van elkaar verwijderd was. Op deze schaal, zelfs de geringste trillingen en bewegingen van het monster zullen het experiment verpesten. "Om afstanden op atomaire schaal te meten, moesten we een speciale, extreem stabiele cryogene microscoop, "Sandoghdar legt uit. "De monsters worden bereid door de eiwitten in een dunne polymeerfilm op een glasplaatje te verdelen."
Hoe zijn eiwitten in een membraan gerangschikt?
In een ander experiment, de onderzoekers toonden aan dat COLD kan worden gebruikt om de ruimtelijke structuur van eiwitten te bepalen:ze labelden een eiwit genaamd streptavidine op vier specifieke plaatsen met fluoroforen en namen enkele honderden beelden op. Vervolgens reconstrueerden ze de structuur van het eiwit met behulp van tomografie-algoritmen. uiteindelijk, ze bereikten een driedimensionale resolutie van ongeveer een halve nanometer bij het lokaliseren van de vier kleurstofmoleculen. "Deze resolutie maakt structuurstudies mogelijk op de limiet van andere methoden in de structurele biologie." Dit geldt in het bijzonder voor het onderzoeksgebied van Christian Griesinger, NMR-spectroscopie, die alleen afstanden van minder dan vijf angstrom kan oplossen. "COLD overbrugt de kloof tussen fluorescentiemicroscopie en structurele biologie, ", zegt de Max Planck-directeur in Göttingen.
De resultaten zijn zeer relevant voor een aantal wetenschappers. "In cellen, eiwitten veranderen hun structuur om hun functies uit te voeren of te veranderen. Bovendien, specifieke structurele veranderingen worden vaak geassocieerd met specifieke ziekten, " zegt Sandoghdar. Bovendien, KOUD kan de oriëntatie van eiwitten bepalen. “Oriëntatie is vooral interessant als je kijkt met eiwitten in een membraan. Dat is het doel van onze huidige experimenten, " legt Daniel Böning uit, een lid van het onderzoeksteam in Erlangen.
Sandoghdar verwacht dat de resolutie van COLD nog een factor tien kan worden verbeterd. De techniek zou dan op atomair niveau werken. Echter, in dat geval zou het botsen met de intrinsieke grens van fluorescentiemicroscopie als gevolg van de grootte van de gebruikte labelmoleculen. “COLD is ideaal om eiwitten of kleinere aggregaten van biomoleculen in beeld te brengen. door de onherbergzame temperaturen, de techniek kan niet worden gebruikt om processen in levende cellen te onderzoeken, "Sandoghdar vat het samen. "Op dit moment, geen enkele microscopiemethode is in staat om alles waar te nemen. De verschillende strategieën moeten daarom – zoals voorheen en voor de nabije toekomst – complementair blijven worden ingezet.”
 Onderzoekers maken slim staal, 30% sterker
Onderzoekers maken slim staal, 30% sterker Wat is Inconel?
Wat is Inconel?  Er komt iets slecht (ruikend) op deze manier - de wetenschap van stoffen en geuren
Er komt iets slecht (ruikend) op deze manier - de wetenschap van stoffen en geuren Wetenschappers ontdekken nieuwe kankerbestrijdende molecule
Wetenschappers ontdekken nieuwe kankerbestrijdende molecule Bindmiddelvrij titanosilicaat van het type MWW voor selectieve en duurzame epoxidatie van propyleen
Bindmiddelvrij titanosilicaat van het type MWW voor selectieve en duurzame epoxidatie van propyleen
 Voor sommige koralen, maaltijden kunnen een kant van microplastics bevatten
Voor sommige koralen, maaltijden kunnen een kant van microplastics bevatten 5 dingen die je niet wist over Paleoart
5 dingen die je niet wist over Paleoart  Schade aan versterkte betonnen muren kan groter zijn dan verwacht bij grote aardbeving in Seattle
Schade aan versterkte betonnen muren kan groter zijn dan verwacht bij grote aardbeving in Seattle Studie:Droogte neemt toe in Europa
Studie:Droogte neemt toe in Europa Trump trekt regels voor brandstofefficiëntie uit het Obama-tijdperk terug
Trump trekt regels voor brandstofefficiëntie uit het Obama-tijdperk terug
Hoofdlijnen
- Science Fair Project Ideas for Dentistry
- Het vinden van een dodelijke parasieten kwetsbaarheden
- Wat is een allel?
- Wanneer citroenen je leven geven:Herpetofauna-aanpassing aan citrusboomgaarden in Belize
- Nieuwe slangensoort verstopt zich in het volle zicht
- Onderzoek bevestigt het:we worden echt dommer
- Bacteriën hebben tastzin
- Wat is een positieve controle in de microbiologie?
- Het kwantumfysica-concept van kritische massa
- Quantumsimulators hebben controle over meer dan 50 qubits, nieuw record vestigen

- Komt er een einde aan het periodiek systeem? MSU-hoogleraar verkent zijn grenzen

- Wetenschappers observeren spiegelachtige fysica van de overgang van supergeleider naar isolator

- Veelbelovende nieuwe methode voor het produceren van kleine vloeibare capsules

- Wetenschappers vinden eindelijk supergeleiding op de plek waar ze al decennia naar op zoek zijn
 Een koeler huis staat in je eigen achtertuin
Een koeler huis staat in je eigen achtertuin Wat is het verschil tussen een inductor en een choke?
Wat is het verschil tussen een inductor en een choke?  Onderzoekers ontdekken dat neerslagdrempels de koolstofuitwisseling reguleren
Onderzoekers ontdekken dat neerslagdrempels de koolstofuitwisseling reguleren Amerikaanse prepping-cultuur beïnvloed door angsten van de media en de overheid
Amerikaanse prepping-cultuur beïnvloed door angsten van de media en de overheid Russisch begint berichten-app Telegram te blokkeren
Russisch begint berichten-app Telegram te blokkeren Het Victoriameer zou in de toekomst vaker buiten haar oevers kunnen treden. Wat gedaan kan worden
Het Victoriameer zou in de toekomst vaker buiten haar oevers kunnen treden. Wat gedaan kan worden Midden-infraroodlaser met hoge helderheid vergroot de horizon van spectroscopische analytische techniek
Midden-infraroodlaser met hoge helderheid vergroot de horizon van spectroscopische analytische techniek Survival of the least-fit:antiviraal middel richt zich selectief op de meest onaangename virussen
Survival of the least-fit:antiviraal middel richt zich selectief op de meest onaangename virussen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

