
Wetenschap
Relatie tussen oppervlakte en reactiesnelheid?
Dit is waarom:
* Meer contactpunten: Een groter oppervlak biedt meer contactpunten tussen de reactanten. Dit betekent dat er meer mogelijkheden zijn voor reactantmoleculen om te botsen en te interageren, wat leidt tot meer succesvolle reacties.
* Verhoogde frequentie van botsingen: Met een groter oppervlak neemt de frequentie van botsingen tussen reactantmoleculen toe, wat op zijn beurt de kans op reacties verhoogt.
* Verminderde activeringsenergie: In sommige gevallen kan een groter oppervlak ook de activeringsenergie verminderen die nodig is om de reactie te starten. Dit komt omdat de reactanten gemakkelijker beschikbaar zijn aan de oppervlakte, waardoor ze gemakkelijker kunnen reageren.
Voorbeelden:
* poedersuiker versus suikerkubus: Poedersuiker lost veel sneller op in water dan een suikerkubus omdat het een veel groter oppervlak heeft dat aan het water wordt blootgesteld.
* brandend hout: Een stapel houtkrullen zal veel sneller verbranden dan een blok van hout omdat de scheerbeurten een veel groter oppervlak hebben dat aan de lucht wordt blootgesteld.
* katalysatoren: Katalysatoren werken door een groter oppervlak te bieden voor de reactanten om op te communiceren, wat de reactiesnelheid verhoogt.
Belangrijke opmerking: Deze relatie geldt voor heterogene reacties , waarbij de reactanten zich in verschillende fasen bevinden (bijvoorbeeld vast en vloeibaar, of vast en gas). In homogene reacties , waar de reactanten zich in dezelfde fase bevinden, speelt het oppervlak een minder belangrijke rol.
 Molecuuleigenschappen veranderen door licht
Molecuuleigenschappen veranderen door licht Gezondere melkchocolade door toevoeging van pinda, koffie verspilling
Gezondere melkchocolade door toevoeging van pinda, koffie verspilling Hoe verschillen natrium- en chloorionen van zoutmoleculen?
Hoe verschillen natrium- en chloorionen van zoutmoleculen?  Verbeterde menselijke bloed-hersenbarrière-chip voert in vivo-achtig transport van geneesmiddelen en antilichamen uit
Verbeterde menselijke bloed-hersenbarrière-chip voert in vivo-achtig transport van geneesmiddelen en antilichamen uit Onderzoekers rapporteren nieuwe hybride katalysator om water te splitsen
Onderzoekers rapporteren nieuwe hybride katalysator om water te splitsen
 NASA vindt nieuwe tropische storm Iselle die al vecht tegen windschering
NASA vindt nieuwe tropische storm Iselle die al vecht tegen windschering Studie voorspelt een dramatische toename van de jaarlijkse hittedagen in het noordoosten van de VS tegen het einde van de eeuw
Studie voorspelt een dramatische toename van de jaarlijkse hittedagen in het noordoosten van de VS tegen het einde van de eeuw Voordelen en nadelen van Ocean Dumping
Voordelen en nadelen van Ocean Dumping Zijn er planten die overwinteren?
Zijn er planten die overwinteren?  Olie- en gasemissies een belangrijke oorzaak van slechte ozondagen
Olie- en gasemissies een belangrijke oorzaak van slechte ozondagen
Hoofdlijnen
- Nieuwe hulpbron legt de innerlijke werking van sorghumplantencellen bloot voor het ontwerpen van betere grondstoffen voor bio-energie
- Welk lichaamssysteem heeft de grootste capaciteit voor pH -verandering in het lichaam?
- Welke 3 manieren voeren bacteriën ademhaling uit?
- Wat scheidt de intracellulaire en extracellulaire vloeistofcompartimenten?
- Wat is de vrouwelijke gameet?
- Wat zou er gebeuren als de micro -organismen uit de voedselketen werden verwijderd?
- Fruitvlieg helpt bij het ontsluiten van aanwijzingen over hoe organen, weefsel en kanker groeien
- 9 Het belangrijkste verschil tussen organismen in domein archaea en eukarya?
- Wat is de celstructuur van Rhizopus stolonifer?
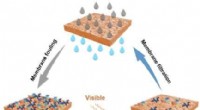
- Wetenschappers ontwikkelen N-gedoteerde zelfreinigende membranen die gebruik maken van bestraling met zichtbaar licht
- Synthese van waardevolle chemicaliën uit verontreinigde grond

- Nieuwe elektrokatalysatoren luiden koolstofneutraliteit in
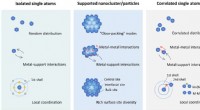
- Insuline sorteren en afscheiden op vervaldatum
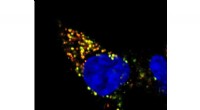
- Apparaat dat moleculaire techniek gebruikt, kan ultragevoelige, geautomatiseerd systeem om virussen te detecteren, ziekte

 Ruimtegegevensrelaissysteem toont zijn snelheid
Ruimtegegevensrelaissysteem toont zijn snelheid AI-project over machine learning wil dat computers anticiperen op wat gebruikers van gegevens willen
AI-project over machine learning wil dat computers anticiperen op wat gebruikers van gegevens willen Wat houdt de twee strengen DNA -moleculen bij elkaar?
Wat houdt de twee strengen DNA -moleculen bij elkaar?  Welk dier heeft enzymen in speeksel?
Welk dier heeft enzymen in speeksel?  De formulemassa van een molecuul of een ion is?
De formulemassa van een molecuul of een ion is?  Wat is een intense lichtstraal?
Wat is een intense lichtstraal?  Landsat 9:De stukjes vallen samen
Landsat 9:De stukjes vallen samen Wat is nodig om Karst -topografie te vormen?
Wat is nodig om Karst -topografie te vormen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

