
Wetenschap
Zijn lipiden vergelijkbaar met watermoleculen?
Hier is een uitsplitsing:
Water:
* Polar: Watermoleculen hebben een positief en negatief einde als gevolg van het ongelijke delen van elektronen in de zuurstofhydrogene bindingen. Met deze polariteit kunnen watermoleculen waterstofbruggen met elkaar vormen, waardoor water samenhangt en een goed oplosmiddel.
* Hydrofiel: Water werkt gemakkelijk samen met en lost andere polaire moleculen op.
* vloeistof bij kamertemperatuur: Vanwege waterstofbinding heeft water een relatief hoog kookpunt en is een vloeistof bij typische temperaturen.
Lipiden:
* nonpolar: Lipiden zijn gemaakt van lange ketens van koolwaterstoffen (koolstof- en waterstofatomen), die elektronen vrij gelijk delen. Dit resulteert in niet -polaire moleculen die niet gemakkelijk waterstofbruggen vormen.
* Hydrofoob: Lipiden weren water af en lossen er niet in.
* vast of vloeistof afhankelijk van de structuur en temperatuur: Lipiden kunnen vast (vetten) of vloeistof (oliën) zijn bij kamertemperatuur, afhankelijk van de lengte en verzadiging van de koolwaterstofketens.
Hier is een analogie:
Beschouw water als een sociale vlinder, gemakkelijk te interageren met andere polaire moleculen. Lipiden zijn als introverte mensen, die liever bij andere lipiden blijven en het waterfeest vermijden.
Belangrijkste verschillen:
* polariteit: Water is polair, lipiden zijn niet -polair.
* Oplosbaarheid: Water is hydrofiel (waterminnende), lipiden zijn hydrofoob (watervissen).
* intermoleculaire krachten: Water vormt sterke waterstofbruggen, lipiden hebben zwakkere Van der Waals -krachten.
Dit verschil in eigenschappen maakt lipiden vitale componenten van celmembranen, terwijl water essentieel is voor de meeste biologische processen.
 Onderzoekers creëren een effectievere hydrogel voor het genezen van wonden
Onderzoekers creëren een effectievere hydrogel voor het genezen van wonden Kunnen fluor en natrium voor een ionische verbinding?
Kunnen fluor en natrium voor een ionische verbinding?  Wetenschappers stellen nieuwe methode voor om atomair gedispergeerde Cu-N-C-katalysator te synthetiseren
Wetenschappers stellen nieuwe methode voor om atomair gedispergeerde Cu-N-C-katalysator te synthetiseren Wat brandt in zuurstof met lila frame?
Wat brandt in zuurstof met lila frame?  Wat is het nut van 2 chloorethanol?
Wat is het nut van 2 chloorethanol?
 Het landschap bepaalt hoe beken hersteld moeten worden
Het landschap bepaalt hoe beken hersteld moeten worden  Evacuaties aangedrongen in de buurt van Guatemala's uitbarstende vulkaan van vuur
Evacuaties aangedrongen in de buurt van Guatemala's uitbarstende vulkaan van vuur Budgetvriendelijke manieren om aan uw vegetarische oplossing te komen als de prijzen stijgen
Budgetvriendelijke manieren om aan uw vegetarische oplossing te komen als de prijzen stijgen Internationale SWOT-satelliet om 's werelds water te onderzoeken
Internationale SWOT-satelliet om 's werelds water te onderzoeken Is een Woodlouse een omnivore carnivore of herbivoor?
Is een Woodlouse een omnivore carnivore of herbivoor?
Hoofdlijnen
- Hoe zou u een multicellulair organisme classificeren met celwanden en chlorofyl?
- Wat beschrijft de bevolking in de wetenschap?
- Wat is een organisme dat een energiebron kan bieden voor virus of een ander organisme?
- Stijfheid en viscositeit van cellen blijken te verschillen bij kanker en andere ziekten
- Welke kins van het systeem wordt gebruikt om individuele soortenorganismen te noemen?
- Wat is de oorsprong van embryo- en endospermzaad?
- Wat was de bijdrage aan de celtheorie?
- Wat is wetenschapper in het Hindi?
- Hoe classificeer je het verschillende apparaat in het laboratorium?
- Onderzoekers koppelen kwartsmicrobalansmetingen aan internationaal meetsysteem

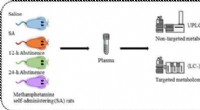
- Een rattenbrein, aan en uit methamfetamine
- Hydrogel met langzame afgifte helpt immunotherapie voor kanker
- Uitbreiding van het temperatuurbereik van lithium-ionbatterijen

- Ingekapselde eiwitoscillaties veroorzaken dynamische membraanvervormingen in cellen

 Lithium heeft één valentie -elektronenbroom zeven elektronen Hoe kunnen ze een chemische binding vormen?
Lithium heeft één valentie -elektronenbroom zeven elektronen Hoe kunnen ze een chemische binding vormen?  Wat zijn de namen van fundamentele tuingereedschapstools?
Wat zijn de namen van fundamentele tuingereedschapstools?  Wat zijn enkele natuurkrachten?
Wat zijn enkele natuurkrachten?  Wat is het meest heterogene koninkrijk in termen van morfologie?
Wat is het meest heterogene koninkrijk in termen van morfologie?  Oostenrijks meer biedt klimaatparadijs voor Nederlandse schaatsers
Oostenrijks meer biedt klimaatparadijs voor Nederlandse schaatsers Bestrijding van verontreiniging van de rivieren kan gevolgen van de klimaatopwarming te beperken
Bestrijding van verontreiniging van de rivieren kan gevolgen van de klimaatopwarming te beperken Methoden van sociale wetenschappers vertalen zich niet altijd goed tussen culturen
Methoden van sociale wetenschappers vertalen zich niet altijd goed tussen culturen Welke boom heeft geen hout?
Welke boom heeft geen hout?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

