
Wetenschap
Welke soorten krachten veroorzaken verbindingen?
* ionische bindingen: Deze worden gevormd wanneer één atoom doneert een elektron naar een ander atoom, waardoor ionen met tegengestelde ladingen worden gecreëerd. De elektrostatische aantrekkingskracht tussen deze ionen houdt de verbinding bij elkaar. Voorbeelden zijn NaCl (tafelzout), waarbij natrium (Na+) een elektron verliest tot chloor (Cl-) en MGO (magnesiumoxide), waarbij magnesium (mg2+) twee elektronen verliest tot zuurstof (O2-).
* Covalente bindingen: Deze worden gevormd wanneer atomen delen Elektronen, die een gebied van elektronendichtheid tussen de atomen creëert. Deze gedeelde elektronendichtheid creëert een aantrekkelijke kracht die de atomen bij elkaar houdt. Voorbeelden zijn H2O (water), waar waterstof (H) atomen elektronen delen met een zuurstof (O) atoom en CO2 (koolstofdioxide), waarbij koolstof (C) elektronen deelt met twee zuurstof (O) atomen.
* metalen bindingen: Deze komen voor in metalen, waarbij de valentie -elektronen worden gedelokaliseerd en gedeeld tussen alle metaalatomen. Dit creëert een "zee" van elektronen die de metaalatomen bij elkaar houden.
Andere krachten die kunnen bijdragen aan samengestelde vorming, hoewel ze zwakker zijn dan elektrostatische krachten, omvatten:
* waterstofbinding: Dit is een speciaal type dipool-dipoolinteractie dat optreedt wanneer waterstof wordt gebonden aan een sterk elektronegatief atoom (zoals zuurstof of stikstof). Het is een sterkere vorm van intermoleculaire kracht dan dipool-dipool interacties, maar nog steeds zwakker dan ionische of covalente bindingen.
* van der Waals krachten: Dit zijn zwakke, tijdelijke attracties die optreden tussen moleculen als gevolg van fluctuaties in elektronenverdeling. Ze zijn belangrijk om niet -polaire moleculen bij elkaar te houden, maar zijn veel zwakker dan ionische of covalente bindingen.
Het is belangrijk om te onthouden dat al deze krachten samenwerken om verbindingen te creëren en te onderhouden. De sterkte van deze krachten bepaalt de eigenschappen van de verbinding, zoals zijn smeltpunt, kookpunt en oplosbaarheid.
 Geminiaturiseerde neuroprobe voor het nemen van monsters van neurotransmitters in de hersenen
Geminiaturiseerde neuroprobe voor het nemen van monsters van neurotransmitters in de hersenen Wat is het contrast tussen fragmentatie en conjugatie?
Wat is het contrast tussen fragmentatie en conjugatie?  Microbellenbevindingen kunnen de chemische, watergebruik bij voedselverwerking
Microbellenbevindingen kunnen de chemische, watergebruik bij voedselverwerking Waarom komt het smelten van ijs voor?
Waarom komt het smelten van ijs voor?  MOF-gegevensset biedt 10, 000 structuren gratis voor academisch onderzoek
MOF-gegevensset biedt 10, 000 structuren gratis voor academisch onderzoek
 Een charachteristisch van een levend wezen dat het helpt om te overleven in zijn omgeving?
Een charachteristisch van een levend wezen dat het helpt om te overleven in zijn omgeving?  Feiten over de Atlantische kustvlaktes
Feiten over de Atlantische kustvlaktes  Vijf vragen over de controversiële Nijldam in Ethiopië
Vijf vragen over de controversiële Nijldam in Ethiopië Hoe walgingsgerelateerd vermijdingsgedrag dieren helpt overleven
Hoe walgingsgerelateerd vermijdingsgedrag dieren helpt overleven  Hoe moeten we spirituele ervaringen interpreteren?
Hoe moeten we spirituele ervaringen interpreteren?
Hoofdlijnen
- Wat zijn de roofdieren van Amoeba?
- Wat zijn enkele vragen die bioloog zou kunnen stellen over de levende wezens die ze bestuderen?
- Welke aanpassingen heeft een Agapanthus?
- Is het waar dat sommige bacteriën geen ziekteverwekkers zijn?
- Man of vrouw? Bij vliegen kunnen sommige cellen het niet zien
- Wat is een gedegenereerd DNA?
- Onderzoekers brengen het menselijk genoom in 4-D in kaart terwijl het vouwt
- Hoe kan onderzoek door één wetenschapper worden gevalideerd?
- Insectenfrass wordt voedsel voor eiwitrijke microalgen
- Chemici synthetiseren miljoenen eiwitten die niet in de natuur voorkomen

- Wetenschappers berekenen kristalstructuur van superharde molybdeenboriden
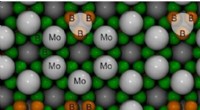
- Neutronen en röntgenstralen gebruiken om de veroudering van lithiumbatterijen te analyseren

- Snelle screening op potentiële nieuwe katalysatoren

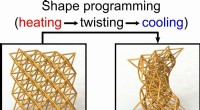
- 4D-geprinte materialen kunnen zo stijf zijn als hout of zacht als een spons
 Waarom reageert mangaanoxide met waterstofperoxide?
Waarom reageert mangaanoxide met waterstofperoxide?  Eerste robotsysteem speelt Tic Tac Toe om de taakprestaties te verbeteren
Eerste robotsysteem speelt Tic Tac Toe om de taakprestaties te verbeteren Microplastics op Antarctica
Microplastics op Antarctica Wordt een chemische vergelijking gebalanceerd wanneer elke som van moleculen hetzelfde is?
Wordt een chemische vergelijking gebalanceerd wanneer elke som van moleculen hetzelfde is?  Hoe wordt elektriciteit geproduceerd uit andere energiebronnen?
Hoe wordt elektriciteit geproduceerd uit andere energiebronnen?  Noem het extra product gevormd wanneer een zuur wordt geneutraliseerd door antacida dat een carbonaat of bicarbonaat bevat?
Noem het extra product gevormd wanneer een zuur wordt geneutraliseerd door antacida dat een carbonaat of bicarbonaat bevat?  Transmissie-elektronenmicroscopie met omgevingsscanning maakt realistischer onderzoek naar katalysatorreacties mogelijk
Transmissie-elektronenmicroscopie met omgevingsscanning maakt realistischer onderzoek naar katalysatorreacties mogelijk Waar zijn de goud- en zilvermijnen in de VS?
Waar zijn de goud- en zilvermijnen in de VS?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

