
Wetenschap
Hoe worden de moleculen in een vloeistof gerangschikt?
Key -kenmerken:
* Nabijheid sluiten: Vloeibare moleculen zijn dicht bij elkaar, vergelijkbaar met vaste stoffen. Dit betekent dat ze sterke intermoleculaire krachten ervaren (zoals waterstofbindingen, dipool-dipoolinteracties of dispersiekrachten in Londen).
* Vrij beweging: In tegenstelling tot vaste stoffen kunnen vloeibare moleculen om elkaar heen bewegen. Ze hebben voldoende energie om de aantrekkelijke krachten te overwinnen en langs elkaar te glijden. Dit verklaart waarom vloeistoffen kunnen stromen en de vorm van hun container kunnen aannemen.
* Geen vaste positie: In tegenstelling tot vaste stoffen hebben vloeibare moleculen geen vaste posities. Ze zijn constant in beweging, vibrerend en roterend, en hun opstelling is dynamischer en minder georganiseerd.
* bestelling op korte afstand: Hoewel niet gefixeerd in een roosterachtige vaste stoffen, vertonen vloeibare moleculen nog steeds een mate van korte afstandsvolgorde. Dit betekent dat een molecuul kan worden omringd door een specifiek aantal aangrenzende moleculen, maar deze opstelling strekt zich niet uit over lange afstanden.
Visualisatie van de opstelling:
Stel je een drukke dansvloer voor. Mensen zijn dicht bij elkaar, maar ze kunnen zich verplaatsen en van positie veranderen, waardoor de algehele opstelling dynamisch en minder vast wordt. Deze analogie kan u helpen de rangschikking van moleculen in een vloeistof te visualiseren.
Belangrijke verschillen van vaste stoffen en gassen:
* vaste stoffen: Moleculen in vaste stoffen zijn strak verpakt in een vaste roosterstructuur, met zeer weinig beweging.
* gassen: Moleculen in gassen liggen ver uit elkaar en bewegen vrij, met zwakke intermoleculaire krachten.
Factoren die invloed hebben op de rangschikking:
De specifieke opstelling van moleculen in een vloeistof hangt af van:
* Type molecuul: Verschillende moleculen hebben verschillende sterkten van intermoleculaire krachten.
* Temperatuur: Hogere temperaturen verhogen de moleculaire beweging, waardoor de opstelling minder geordend is.
* Druk: Hogere druk kan moleculen dichter bij elkaar dwingen, waardoor de volgorde toeneemt.
Laat het me weten als je nog vragen hebt over de eigenschappen van vloeistoffen!
 Hoe je van een vulkaan een krachtcentrale maakt – met een beetje hulp van satellieten
Hoe je van een vulkaan een krachtcentrale maakt – met een beetje hulp van satellieten What does the word natural light mean?
What does the word natural light mean?  Hoe een ‘CERN’ voor de landbouwwetenschap eruit zou kunnen zien
Hoe een ‘CERN’ voor de landbouwwetenschap eruit zou kunnen zien  Onderzoek heeft bijgedragen tot de vorming van een natuurreservaat in Vietnam
Onderzoek heeft bijgedragen tot de vorming van een natuurreservaat in Vietnam Welke voetgangers plantte appelbomen in de Amerikaanse wildernis?
Welke voetgangers plantte appelbomen in de Amerikaanse wildernis?
Hoofdlijnen
- Wat eten Planton?
- Wat is de subeenheid van een DNA -molecuul dat wordt genoemd?
- Waarom is het voor meiose neceesary om cellen te produceren met minder chromosomen?
- Wat zijn de functies van de basis- en armmicroscoop?
- Wie was de wetenschapper die voor het eerst microscopische planten en ander organisme observeerde met behulp van microscoop?
- Hoe worden planten met transportweefsels genoemd?
- Wat helpt kleine plantachtige organismen te groeien op het oppervlak van de oceaan?
- Klimaatverandering kan bamboe-lemuren langzaam uithongeren
- Welke organellen in anafase zijn belangrijk voor het deel van de celdeling?
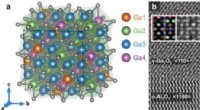
- Galliumoxidekristalcomplexiteit getemd door machine learning
- Hoe een zeer sociaal eiwit aanwijzingen kan bevatten over de oorsprong van Alzheimer

- De cryo-elektronenmicroscopiestructuur van huntingtine

- Licht schijnen op de scheiding van zeldzame aardmetalen
- Kristaloorlogen:onderzoek kan leiden tot efficiëntere methoden voor kristaltechnologie

 Hoe kunt u de moleculaire formule van een verbinding vinden wanneer de percentagesamenstelling wordt gegeven?
Hoe kunt u de moleculaire formule van een verbinding vinden wanneer de percentagesamenstelling wordt gegeven?  Hoe ID Mountain Lion Poop
Hoe ID Mountain Lion Poop  Hoe zijn de kaarten getekend door Ptolemaeus en een revolutie teweeggebracht in Europese zee -verkenning?
Hoe zijn de kaarten getekend door Ptolemaeus en een revolutie teweeggebracht in Europese zee -verkenning?  Elektronencorrelaties in koolstofnanostructuren
Elektronencorrelaties in koolstofnanostructuren Wat zijn atomen van verschillende elementen waarvan wordt gezegd dat ze worden genoemd?
Wat zijn atomen van verschillende elementen waarvan wordt gezegd dat ze worden genoemd?  Hoe een Macedonische stad een nepnieuws-epicentrum werd
Hoe een Macedonische stad een nepnieuws-epicentrum werd Klein molecuul speelt buitenmaatse rol bij het beheersen van nanodeeltjes
Klein molecuul speelt buitenmaatse rol bij het beheersen van nanodeeltjes Een laag van een miljoen jaar oude zandsteen die bovenop een 1,5 graniet ligt, is een voorbeeld van?
Een laag van een miljoen jaar oude zandsteen die bovenop een 1,5 graniet ligt, is een voorbeeld van?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

