
Wetenschap
Wat is het volume van 1 liter water in damp?
* Waterdamp gaat aanzienlijk uit: Wanneer water verandert van een vloeistof in een gas (damp), verspreiden de moleculen zich veel verder uit elkaar. Dit betekent dat het volume van de damp veel groter is dan het volume van de vloeistof waar het vandaan kwam.
* Volume hangt af van voorwaarden: Het volume waterdamp is sterk afhankelijk van temperatuur en druk. Bij hogere temperaturen bewegen de moleculen sneller en nemen ze meer ruimte in beslag. Bij hogere druk worden de moleculen dichter bij elkaar gedwongen.
Wat u kunt doen:
* Bereken de massa: 1 liter water heeft een massa van 1 kilogram (omdat 1 liter water een dichtheid van 1 kg/l heeft).
* Gebruik de ideale gaswet: De ideale gaswet (PV =NRT) kan worden gebruikt om het volume waterdamp te berekenen als u de temperatuur, druk en mol waterdamp kent.
* Beschouw een specifiek volume: U kunt het specifieke volume waterdamp opzoeken bij verschillende temperaturen en drukken. Specifiek volume is het volume bezet door een eenheidsmassa van de stof.
Voorbeeld:
Stel dat u het volume van 1 kilogram waterdamp bij 100 ° C (373 K) en 1 atmosfeer van druk wilt vinden.
1. Moles: 1 kilogram water is ongeveer 55,5 mol (met behulp van de molaire watermassa van water:18 g/mol).
2. Ideale gaswet: Met behulp van de ideale gaswet (PV =NRT), waar:
* P =1 ATM
* n =55,5 mol
* R =0,0821 l⋅atm/(mol⋅K) (ideale gasconstante)
* T =373 K
* Oplossen voor V (volume), krijgen we:V ≈ 1620 l
Belangrijke opmerking: Dit is slechts een voorbeeld. Het volume waterdamp zal dramatisch veranderen met variaties in temperatuur en druk.
 Koude lucht stijgt op – wat dat betekent voor het klimaat op aarde
Koude lucht stijgt op – wat dat betekent voor het klimaat op aarde  Hoe weet je of een eekhoorn mannelijk of vrouwelijk is
Hoe weet je of een eekhoorn mannelijk of vrouwelijk is Hoe kunnen aardbevingen mensen en het land beïnvloeden?
Hoe kunnen aardbevingen mensen en het land beïnvloeden?
Wanneer een zijde van een transformatiegrenzing naar het noorden en het andere naar het zuiden beweegt, zoals met de fout van San Andreas, beweegt de grond en rammelt en schudt alles binnen he
 Het vrijkomen van methaan neemt snel toe in het kielzog van de smeltende ijskappen
Het vrijkomen van methaan neemt snel toe in het kielzog van de smeltende ijskappen Het eerste gebruik van weersvoorspellingen om de menselijke impact op extremen aan te tonen is 'transformationeel', zeggen wetenschappers
Het eerste gebruik van weersvoorspellingen om de menselijke impact op extremen aan te tonen is 'transformationeel', zeggen wetenschappers
Hoofdlijnen
- Kenmerken die altijd aanwezig zijn in een levend organisme omvatten cellen metabolisme reproductie homeostase en?
- Welke voedingsstoffen worden in het water gemengd om zaad te laten groeien in een verticale landbouw van een plant?
- Gewonde zeeschildpad genezen met 3D-printen
- Wat is de functie van mitochondriën in eukayotische organismen?
- Trofisch niveau (voedselketen en web): definitie en voorbeelden (met diagram)
- Behoud oproep aan zaagviskwekerij
- Noem de 2 dingen die meedoen om een zaadje te maken?
- Onderzoekers laten zien hoe het ontwerp van gebouwen de bacteriën binnenshuis beïnvloedt
- Hoe helpen reflexen organismen te overleven?
- De zoete smaak van innovatie

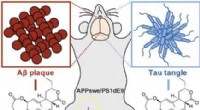
- Wortelbacterie om Alzheimer te bestrijden:Rhizolutin dissocieert bèta- en tau-aggregaten
- Laserbehandeling toont potentieel voor vermindering van industriële chemische verwerking van voertuigen

- Microbiële cyborgs:bacteriën die energie leveren

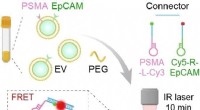
- Snel, ongecompliceerd en specifiek:diagnose van prostaatkanker op basis van bloedmonsters
 NASA klaar om hart van Mars te bestuderen
NASA klaar om hart van Mars te bestuderen Verschil tussen heterotrofen en autotrofen
Verschil tussen heterotrofen en autotrofen  Wat is de evenwichtige vergelijking voor de reactie van ammoniakdamp en waterstofsulfidegas om vast ammoniumsulfide te produceren?
Wat is de evenwichtige vergelijking voor de reactie van ammoniakdamp en waterstofsulfidegas om vast ammoniumsulfide te produceren?  Wat drijft het proces van plaattektoniek aan.
Wat drijft het proces van plaattektoniek aan.  Wetenschappers tonen aan dat een veelbelovende vaste elektrolyt hydrofoob is
Wetenschappers tonen aan dat een veelbelovende vaste elektrolyt hydrofoob is Bijdragen van veengebieden aan waterveiligheid in het VK
Bijdragen van veengebieden aan waterveiligheid in het VK Hoe omgevingsenergie het internet der dingen zou kunnen aandrijven
Hoe omgevingsenergie het internet der dingen zou kunnen aandrijven  Team ontdekt uniek materiaal voor het kwantumtijdperk
Team ontdekt uniek materiaal voor het kwantumtijdperk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

