
Wetenschap
Wat is het verschil tussen emissie en absorptie in termen van wat er met een elektronenatoom gebeurt?
absorptie:
* wat gebeurt er: Een elektron wint energie door een foton te absorberen (een pakje lichte energie).
* energieniveau: Het elektron springt van een lager energieniveau naar een hoger energieniveau binnen het atoom.
* resultaat: Het atoom bevindt zich nu in een opgewonden toestand .
emissie:
* wat gebeurt er: Een elektron verliest energie door een foton uit te zenden.
* energieniveau: Het elektronen daalt van een hoger energieniveau naar een lager energieniveau binnen het atoom.
* resultaat: Het atoom keert terug naar een stabielere, lagere energietoestand , en licht wordt uitgezonden.
Visualiseren van het verschil:
Stel je een elektron voor als een bal op een trap.
* absorptie: De bal absorbeert energie en springt naar een hogere stap op de trap.
* emissie: De bal verliest energie en valt naar een lagere stap op de trap.
Sleutelpunten:
* Energiebesparing: Beide processen houden zich aan het principe van energiebesparing. De energie die wordt geabsorbeerd of uitgestoten door het elektron is precies gelijk aan de energie van het betrokken foton.
* specifieke frequenties: Elk element heeft unieke energieniveaus, wat betekent dat het licht absorbeert en uitzendt bij specifieke frequenties (kleuren). Dit is wat elementen hun karakteristieke spectrale lijnen geeft.
* Toepassingen: Deze processen zijn van fundamenteel belang voor verschillende technologieën, waaronder lasers, spectroscopie en fluorescerende verlichting.
Laat het me weten als je meer details wilt over een van deze aspecten!
 Luchtvervuiling kost Utahns miljarden per jaar en verkort de levensverwachting met twee jaar
Luchtvervuiling kost Utahns miljarden per jaar en verkort de levensverwachting met twee jaar Orkaan Lorena komt aan land in Los Cabos-resort in Mexico (update)
Orkaan Lorena komt aan land in Los Cabos-resort in Mexico (update) In het kielzog van Harvey, Houston moet de planningsregels wijzigen
In het kielzog van Harvey, Houston moet de planningsregels wijzigen Vier hoofdonderdelen van een fabriek
Vier hoofdonderdelen van een fabriek  Duitsland tekent vlaggenschip klimaatplan
Duitsland tekent vlaggenschip klimaatplan
Hoofdlijnen
- Hoe worden obligaties gedefinieerd?
- Wanneer een organisme zonder zuurstof kan overleven, wordt dit dit genoemd?
- Welke structuur van elke soort lichaamscel is geschikt voor wat?
- Hoe zorgwekkend is de verspreiding van de vogelgriep naar melkkoeien? Dit is wat experts zeggen
- Wat is een sientific theorie?
- Welke cellen zijn verantwoordelijk voor celdeling en groei in planten?
- Microbiële structuren in het Antarctische meer zouden meer kunnen onthullen over hoe het leven zich ontwikkelde
- Wanneer kan het fenotype je genotype van een eigenschap vertellen?
- RNA-mutatie vs. DNA-mutatie
- Een manier om tegen lage kosten schonere metaalvrije perovskieten te maken
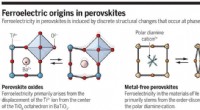
- Commercieel relevante op bismut gebaseerde dunnefilmverwerking

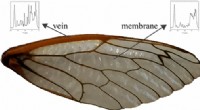
- Hoe krekels erin slagen om het te vleugelen
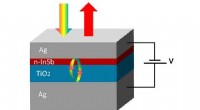
- Onderzoekers komen op de golflengte van de consument met InSb-technologie
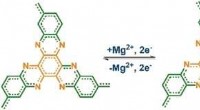
- Polymeerkathode met hoge energiedichtheid voor snelladende natrium- en multivalent-ionbatterijen
 Welk zuur verwacht je als bestanddeel van loog aan te treffen?
Welk zuur verwacht je als bestanddeel van loog aan te treffen?  Hoe wordt werk gerelateerd aan kracht en verplaatsing besproken in termen van basiseenheden?
Hoe wordt werk gerelateerd aan kracht en verplaatsing besproken in termen van basiseenheden?  Nieuwe concepten voor het besturen van verkenningsrovers
Nieuwe concepten voor het besturen van verkenningsrovers Wat vertegenwoordigen de lijnen tussen zuurstof en waterstof?
Wat vertegenwoordigen de lijnen tussen zuurstof en waterstof?  De grote ribosomale eenheid heeft bindingsplaatsen voor?
De grote ribosomale eenheid heeft bindingsplaatsen voor?  Nieuwe biosyntheseroute die uniek is voor pathogene micro-organismen
Nieuwe biosyntheseroute die uniek is voor pathogene micro-organismen Hoe vormen de afzetting vormgeven?
Hoe vormen de afzetting vormgeven?  Waar hebben elektronen de neiging zich te vestigen?
Waar hebben elektronen de neiging zich te vestigen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

