
Wetenschap
Wat zijn de verschillen in bewegingen en regelingen deeltjes vaste stoffen vloeistoffen?
vaste stoffen
* arrangement: Deeltjes zijn strak verpakt in een normaal, herhaaldelijk patroon (kristalrooster). Deze structuur geeft vaste stoffen hun vaste vorm en volume.
* beweging: Deeltjes trillen op hun plaats, maar ze bewegen niet vrij uit hun posities. De trillingen nemen toe met de temperatuur.
vloeistoffen
* arrangement: Deeltjes zijn dicht bij elkaar, maar ze kunnen zich om elkaar heen bewegen (meer vrijheid dan vaste stoffen). Ze zijn niet gerangschikt in een vast patroon.
* beweging: Deeltjes bewegen vrijer dan in vaste stoffen en glijden constant langs elkaar. Hierdoor kunnen vloeistoffen de vorm van hun container aannemen, maar een vast volume behouden.
gassen
* arrangement: Deeltjes staan ver uit elkaar en hebben geen vaste opstelling. Ze bewegen vrij in alle richtingen.
* beweging: Deeltjes bewegen met hoge snelheden, botsen met elkaar en de wanden van hun container. Dit creëert druk.
Key Takeaways
* Afstand tussen deeltjes: Verhoogt van vaste stoffen tot vloeistoffen tot gassen.
* opstelling van deeltjes: Regelmatig en vast in vaste stoffen, minder geordend in vloeistoffen, en volledig ongeordend in gassen.
* deeltjesbeweging: Trillingen in vaste stoffen, glijden in vloeistoffen en vrij verkeer in gassen.
Denk er op deze manier aan:
* solide: Stel je een strak verpakte menigte mensen voor, die allemaal op hun plaats staan, maar een beetje trillen.
* vloeistof: Stel je dezelfde menigte voor, maar nu kunnen mensen om elkaar heen bewegen, stoten en trekken.
* gas: Stel je voor dat de menigte zich heeft verspreid, iedereen die vrij in alle richtingen beweegt, tegen elkaar en de muren van de kamer tegen het punt stoot.
De energie van de deeltjes speelt een cruciale rol:
* Hogere temperatuur: Meer kinetische energie, wat leidt tot grotere deeltjesbeweging en een neiging om naar een meer ongeordende toestand (zoals vloeistof of gas) te bewegen.
* Lagere temperatuur: Minder kinetische energie, wat leidt tot langzamere deeltjesbeweging en een neiging om meer te worden geordend (als een vaste stof).
 Wat zijn de verschillende zouten die worden geproduceerd door natriumhydroxide te reageren met fosforzuur?
Wat zijn de verschillende zouten die worden geproduceerd door natriumhydroxide te reageren met fosforzuur?  Reageren metalen met andere metalen?
Reageren metalen met andere metalen?  Wat is een huishoudelijke ammoniakstof of -mengsel?
Wat is een huishoudelijke ammoniakstof of -mengsel?  Kunnen watermoleculen verdampen aan het oppervlak of onder het oppervlak?
Kunnen watermoleculen verdampen aan het oppervlak of onder het oppervlak?  Het is geen vibranium of proto-adamantium, maar onderzoekers nieuwe legering komt in de buurt
Het is geen vibranium of proto-adamantium, maar onderzoekers nieuwe legering komt in de buurt
 Hoe deep learning automatische clouddetectie naar nieuwe hoogten brengt
Hoe deep learning automatische clouddetectie naar nieuwe hoogten brengt Waarom is het voor wetenschappers moeilijk om te weten hoe de binnenkant van de aarde eruit ziet?
Waarom is het voor wetenschappers moeilijk om te weten hoe de binnenkant van de aarde eruit ziet?  Klimaatbereide landen verliezen terrein, recente indexshows
Klimaatbereide landen verliezen terrein, recente indexshows Techniek op nanoschaal brengt lichtdraaiende materialen naar extremere omgevingen
Techniek op nanoschaal brengt lichtdraaiende materialen naar extremere omgevingen  De hoeveelheid van wat in het algemeen vegetatie bepaalt in een tropisch regenwoud?
De hoeveelheid van wat in het algemeen vegetatie bepaalt in een tropisch regenwoud?
Hoofdlijnen
- Hoe zijn de reproductieve organen of een mannelijk en vrouwelijk hetzelfde hoe ze verschillen?
- Welk macromolecuul vormt een enzym?
- Welke term wordt gedefinieerd als een molecuul gevormd door twee monosachariden?
- Welk deel van een dierencel is vergelijkbaar met je huid?
- Welk bewijs bestaat om het idee te ondersteunen dat Archaea nauwer gerelateerde eukaryoten zijn in plaats van bacteriën?
- Wereldwijde explosie van wegenbouw kan rampzalig zijn voor mens en natuur, zeggen wetenschappers
- De structuren identificeren die een dierlijke cel omvatten?
- Wat is een genclustering?
- Waarom heb je ervoor gekozen om biologie te studeren?
- Een 40-jarige katalysator onthult zijn geheimen

- Onthulling van de onverwachte structuur van ijzer-exporteur ferroportine
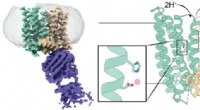
- Polyproline beschermt celmonolagen tegen vorstschade
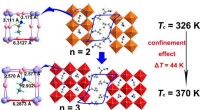
- Onderzoekers verwerven gelaagde metaalhalogenide-ferro-elektriciteit met hoge Curie-temperatuur via kooi-begrensde ethylaminerotators
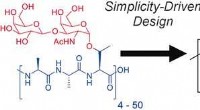
- Nieuwe methodologie verhoogt de resolutie in proteomics van oligodendrocyten

 Waarom kan sonar de afstand tussen de aarde en de maan niet vinden?
Waarom kan sonar de afstand tussen de aarde en de maan niet vinden?  Mentoren spelen een cruciale rol in de kwaliteit van de universiteitservaring, nieuwe peiling suggereert
Mentoren spelen een cruciale rol in de kwaliteit van de universiteitservaring, nieuwe peiling suggereert Wat gebeurt er met een oplosbare vaste stof als het toegevoegd water is?
Wat gebeurt er met een oplosbare vaste stof als het toegevoegd water is?  Wat is de belangrijkste reden dat een bal niet zo ver rolt op een tapijt op een houten vloer?
Wat is de belangrijkste reden dat een bal niet zo ver rolt op een tapijt op een houten vloer?  Hoe kan energie worden gecreëerd door te transformeren?
Hoe kan energie worden gecreëerd door te transformeren?  De aanvallen tonen de omvang van het gevaar voor schubdieren aan
De aanvallen tonen de omvang van het gevaar voor schubdieren aan  Hoe bomen de atmosfeer veranderen
Hoe bomen de atmosfeer veranderen  Onthulling van het mechanisme van fotoluminescentiestabilisatie in halfgeleider nanodeeltjes
Onthulling van het mechanisme van fotoluminescentiestabilisatie in halfgeleider nanodeeltjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

