
Wetenschap
Welke van de volgende eigenschappen kan worden toegeschreven aan feiten dat elektronen worden gedelokaliseerd en in staat zijn vrij te bewegen in metalen kristallen?
Eigenschappen toe te schrijven aan gedelokaliseerde elektronen:
* Hoge elektrische geleidbaarheid: Omdat elektronen vrij door het kristalrooster kunnen bewegen, kunnen ze gemakkelijk een elektrische stroom dragen. Dit is de reden waarom metalen uitstekende elektriciteitsgeleiders zijn.
* Hoge thermische geleidbaarheid: Het vrije verkeer van elektronen zorgt voor een efficiënte overdracht van warmte -energie. Dit is de reden waarom metalen ook goede warmtegeleiders zijn.
* Metallic Luster: De vrije elektronen in een metaal kunnen licht absorberen en opnieuw oplossen, waardoor metalen hun karakteristieke glanzende uiterlijk krijgen.
* kneedbaarheid en ductiliteit: Het vermogen van metalen om in dunne vellen (kneedbaarheid) of getrokken draden (ductiliteit) te worden gehamerd, is te wijten aan de delokaliseerde elektronen. Deze elektronen werken als een "lijm" die de metaalionen bij elkaar houdt, waardoor het metaal kan worden vervormd zonder te breken.
* dekking: De gedelokaliseerde elektronen in metalen absorberen gemakkelijk alle golflengten van zichtbaar licht, waardoor ze ondoorzichtig zijn.
Waarom gedelokaliseerde elektronen tot deze eigenschappen leiden:
* zee van elektronenmodel: De elektronen in een metalen kristal zijn niet gebonden aan specifieke atomen, maar vormen eerder een "zee" van gedelokaliseerde elektronen die vrij zijn om door de hele structuur te bewegen.
* Gratis elektronentheorie: Dit model verklaart de elektrische en thermische geleidbaarheid van metalen. Het stelt dat de vrije elektronen gemakkelijk kunnen bewegen onder invloed van een elektrisch veld of temperatuurgradiënt.
* Collectief gedrag: De gedelocaliseerde elektronen gedragen zich als een collectief en dragen bij aan de algemene eigenschappen van het metaal.
Samenvattend: Het vermogen van elektronen om vrij te bewegen in een metalen kristal is de sleutel tot het begrijpen van de unieke eigenschappen van metalen. Ze zijn uitstekende geleiders van elektriciteit en warmte, hebben een karakteristieke metalen glans, zijn kneedbaar en ductiel en zijn ondoorzichtig.
 Hoeveel zuurstofatoom bevinden zich in 5 moleculen OH H2SO4?
Hoeveel zuurstofatoom bevinden zich in 5 moleculen OH H2SO4?  Wat is de hexaiodine deca carbide -formule?
Wat is de hexaiodine deca carbide -formule?  Een ionische verbinding met een polyatomisch kation en anion. Zijn de atomen in de groep allemaal van dezelfde groep?
Een ionische verbinding met een polyatomisch kation en anion. Zijn de atomen in de groep allemaal van dezelfde groep?  Is koolmonoxide een ionische verbinding?
Is koolmonoxide een ionische verbinding?  Een goede zaak beter maken:een zuurtest die niet in water verdrinkt
Een goede zaak beter maken:een zuurtest die niet in water verdrinkt
 Hoe maak je je eigen hertenvoedsel Block
Hoe maak je je eigen hertenvoedsel Block De verschillen tussen een stekelvarken en een egel
De verschillen tussen een stekelvarken en een egel  Voordelen en nadelen van bebossing
Voordelen en nadelen van bebossing  Plaattektoniek legt de puzzel van de verschuivende aardkorst samen
Plaattektoniek legt de puzzel van de verschuivende aardkorst samen  Onderzoekers ontwikkelen app om gebieden te detecteren die het meest kwetsbaar zijn voor levensbedreigende waas
Onderzoekers ontwikkelen app om gebieden te detecteren die het meest kwetsbaar zijn voor levensbedreigende waas
Hoofdlijnen
- Waarom gebruik je ijskoude toestand in de cellysis?
- Gentherapie kan kreupelheid bij paarden genezen, onderzoek vindt
- Wat is nephoning en waarom hebben de officiële tests dit niet opgepikt?
- Wat kun je afleiden als de functie van het diafragma in een microscoop?
- Wat is eenvoudig micro -organisme met één cellen?
- Is rhizoïden autotrofe voeding of hetetrofische voeding?
- Wat is de geslachts- en soortnaam van een plant?
- Wat is een belangrijk kenmerk van de wetenschappelijke methode?
- Waarom sommige mensen flauwvallen als ze bloed zien
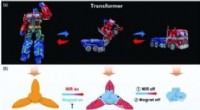
- Magnetisch gestuurd, op hydrogel gebaseerde slimme transformatoren
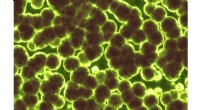
- Studie ontrafelt hoe microben een belangrijke stof produceren die wordt gebruikt om kanker te bestrijden
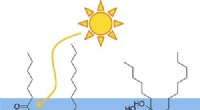
- De radicale manieren waarop zonlicht grotere moleculen in de atmosfeer bouwt
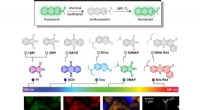
- Schakelaar met één atoom laadt fluorescerende kleurstoffen op
- Algoritme leidt tot een dramatische verbetering van methoden voor het ontdekken van geneesmiddelen
 Hoe ziet Einsteinium eruit?
Hoe ziet Einsteinium eruit?  Vier elementen maken een 2D optisch platform
Vier elementen maken een 2D optisch platform Als de steile kant van een drumlin op het noordoosten is, geeft dit aan dat gletsjer uit welke richting is gebracht?
Als de steile kant van een drumlin op het noordoosten is, geeft dit aan dat gletsjer uit welke richting is gebracht?  Hoeveel gram natriumchloride bevindt zich in 0,40 mol?
Hoeveel gram natriumchloride bevindt zich in 0,40 mol?  Klein plankton herstelt traag na botsing met asteroïden die dinosauriërs doden
Klein plankton herstelt traag na botsing met asteroïden die dinosauriërs doden Als je een bal boven de grond houdt, heeft het kinetische energie?
Als je een bal boven de grond houdt, heeft het kinetische energie?  Studie toont het uitdoven van een antiferromagneet in toestanden met hoge weerstand aan
Studie toont het uitdoven van een antiferromagneet in toestanden met hoge weerstand aan Onderzoekers ontwikkelen milieuvriendelijke magneet om microplastics te bestrijden
Onderzoekers ontwikkelen milieuvriendelijke magneet om microplastics te bestrijden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

