
Wetenschap
Wat is resonantie in de organische chemie?
Resonantie in organische chemie:delocaliseerde elektronen en stabiliteit
Resonantie is een cruciaal concept in de organische chemie dat ons helpt de structuur, reactiviteit en stabiliteit van moleculen te begrijpen. Het beschrijft een situatie waarin de daadwerkelijke structuur van een molecuul niet kan worden weergegeven door een enkele Lewis -structuur , maar eerder als een hybride van meerdere bijdragende structuren . Deze bijdragende structuren, ook bekend als resonantiestructuren, verschillen alleen in de plaatsing van elektronen, met name PI -elektronen en eenzame paren.
Key Concepts:
* delocalisatie: Resonantie treedt op wanneer elektronen niet beperkt zijn tot een enkel atoom of binding, maar verspreid over verschillende atomen . Deze delocalisatie wordt weergegeven door gebogen pijlen De beweging van elektronen tonen.
* bijdragende structuren: Elke resonantiestructuur is een geldige Lewis -structuur, maar geen enkele alleen vertegenwoordigt nauwkeurig de ware structuur van het molecuul.
* resonantie hybride: Het werkelijke molecuul is een gewogen gemiddelde van alle bijdragende structuren , met de meest stabiele structuren die meer bijdragen.
* stabiliteit: Resonantie delocalisatie van elektronen stabiliseert moleculen Door de elektronendichtheid over een groter gebied te verdelen, de afstoting van elektronen-elektronen te verminderen en de algehele stabiliteit van het systeem te vergroten.
Voorbeeld:benzeen
Benzeen (C6H6) is een klassiek voorbeeld van resonantie. De zes koolstofatomen vormen een ring met afwisselende enkele en dubbele bindingen. De werkelijke structuur van benzeen is echter een hybride van twee resonantiestructuren , waarbij de dubbele bindingen over de hele ring worden gedelokaliseerd. Deze delocalisatie geeft Benzeen een unieke stabiliteit en verklaart zijn eigenschappen.
Hoe resonantie te herkennen:
* Aanwezigheid van afwisselende enkele en dubbele bindingen: Dit suggereert vaak PI -elektronendelocalisatie.
* eenzame paren op atomen grenzend aan dubbele of drievoudige bindingen: Deze enige paren kunnen deelnemen aan resonantie.
* Positieve ladingen naast dubbele of drievoudige bindingen: De positieve lading kan worden gedelokaliseerd door de PI -elektronen te verschuiven.
Belang van resonantie in organische chemie:
* Voorspelling van reactiviteit: Resonantiestructuren helpen voorspellen waar een molecuul het meest waarschijnlijk zal reageren.
* Stabiliteit begrijpen: Moleculen met meer resonantiestructuren zijn over het algemeen stabieler.
* Eigenschappen uitleggen: Resonantie verklaart de ongebruikelijke stabiliteit van bepaalde moleculen, zoals benzeen en aromatische verbindingen.
Inzicht in resonantie is essentieel voor het begrijpen van het gedrag van organische moleculen en voor het succesvol voorspellen van hun reacties en eigenschappen.
 Vulkaanuitbarsting in het Verre Oosten van Rusland lokt waaghalzige toeristen
Vulkaanuitbarsting in het Verre Oosten van Rusland lokt waaghalzige toeristen Air India stopt met het gebruik van plastic voor eenmalig gebruik op vluchten
Air India stopt met het gebruik van plastic voor eenmalig gebruik op vluchten Fort Lauderdale overweegt wegen te verhogen om de stijgende zeeën te bestrijden
Fort Lauderdale overweegt wegen te verhogen om de stijgende zeeën te bestrijden  Simuleren van meteorietinslagen in het laboratorium
Simuleren van meteorietinslagen in het laboratorium Dit is wat supermarkten zouden moeten doen om de planeet te helpen
Dit is wat supermarkten zouden moeten doen om de planeet te helpen
Hoofdlijnen
- Onderzoek naar stafylokok laat zien hoe bacteriën resistentie ontwikkelen
- Is eiwit in bloed een mengsel?
- Welke suiker heeft RNA dat anders is dan het in DNA?
- De eigenschap wordt er een uitgedrukt in een hybride organisme?
- Wat is Thermostix?
- Hoe receptoren voor medicijnen in cellen werken
- Waar staat ATP voor en wat betekent het in cellulaire ademhaling?
- Invasieve kikkers geven invasieve vogels een boost op Hawaï
- Komt glycolyse op binnen of buiten de mitochondria?
- Het terugwinnen van fosfor uit de productie van maïs-ethanol kan de grondwatervervuiling helpen verminderen

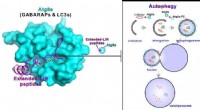
- Wetenschappers ontdekken autofagieremmende peptiden van gigantische ankyrinen
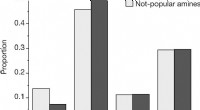
- Chemici laten zien hoe vooringenomenheid kan opduiken in de resultaten van machine learning-algoritmen
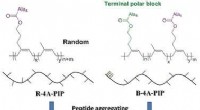
- Biomimetische strategie leidt tot sterke, recyclebaar rubber
- Energie-oogstende kunststoffen doorstaan de zuurtest

 Wat is het belang van topografische kaarten?
Wat is het belang van topografische kaarten?  Welk element is het meest reactieve uit nikkelchloorhelium en ijzer?
Welk element is het meest reactieve uit nikkelchloorhelium en ijzer?  Uber aangeklaagd nadat door hackers gestolen data verborgen waren
Uber aangeklaagd nadat door hackers gestolen data verborgen waren Wat zijn de meters van een deeltje van 68 nm lang?
Wat zijn de meters van een deeltje van 68 nm lang?  Wat is de versnelling van een object van 50 kg geduwd met kracht 500 Newton?
Wat is de versnelling van een object van 50 kg geduwd met kracht 500 Newton?  Hoe het Gemini-ruimtevaartuig werkte
Hoe het Gemini-ruimtevaartuig werkte  Wat hebben El Nino en La Nina gemeen?
Wat hebben El Nino en La Nina gemeen?  Nieuw bewijs van LHC toont aan dat pentaquark een molecuulachtige structuur heeft
Nieuw bewijs van LHC toont aan dat pentaquark een molecuulachtige structuur heeft
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

