
Wetenschap
Is Boyles rechten van toepassing op vloeistoffen?
* de wet van Boyle stelt: Het volume van een gas is omgekeerd evenredig met de druk, uitgaande van een constante temperatuur. Deze relatie komt voort uit de samendrukbaarheid van gassen.
* Vloeistoffen zijn relatief niet te samendrukbaar: In tegenstelling tot gassen hebben vloeistoffen veel sterkere intermoleculaire krachten die hun moleculen dicht bij elkaar houden. Dit maakt ze veel minder samendrukbaar. Het uitoefenen van druk op een vloeistof veroorzaakt slechts een zeer kleine verandering in het volume.
Er zijn echter een aantal indirecte manieren waarop Boyle's wet kan worden betrokken:
* oplossingen: Als een gas in een vloeistof wordt opgelost, zal de druk van het gas boven de oplossing de oplosbaarheid van het gas in de vloeistof beïnvloeden. Dit is gerelateerd aan de wet van Henry, die analoog is aan de wet van Boyle voor gassen opgelost in vloeistoffen.
* dampdruk: Vloeistoffen hebben een dampdruk die wordt beïnvloed door temperatuur. Deze dampdruk kan worden beschouwd als een gas in evenwicht met de vloeistof, en de wet van Boyle zou van toepassing zijn op de gasfase.
In wezen, hoewel de wet van Boyle niet direct van toepassing is op het bulkgedrag van vloeistoffen, kunnen de principes erachter nog steeds invloed hebben op bepaalde fenomenen met vloeistoffen en gassen.
 NASA krijgt infraroodbeeld van de subtropische storm van Atlantische Halloween
NASA krijgt infraroodbeeld van de subtropische storm van Atlantische Halloween Wat is het doel van grondwater als het in de grond wordt gevonden?
Wat is het doel van grondwater als het in de grond wordt gevonden?  Prachtige verloren vintage uit Bordeaux drijft kleine telers tot het uiterste
Prachtige verloren vintage uit Bordeaux drijft kleine telers tot het uiterste Hoe wordt het proces genaamd waar een onderzoeksonderzoek wordt geaccepteerd als waar en wetenschappelijk?
Hoe wordt het proces genaamd waar een onderzoeksonderzoek wordt geaccepteerd als waar en wetenschappelijk?  Welke soorten dingen vervuilen water?
Welke soorten dingen vervuilen water?
Hoofdlijnen
- Wat zijn de verschillende plantenorganen?
- Wat is een andere naam van transgene organisme?
- Het bestuderen van roofzuchtig gedrag in het bacterierijk
- Wat zit er in een naam? Big Data onthult onderscheidende patronen in hogeronderwijssystemen
- Welk eten heeft enzym?
- Wat is een biocenose?
- Hoe verschillen circulerende hormonen van paracrinen en autocrinen met betrekking tot hun doelcellen?
- Onderzoekers traceren de oorsprong van aardappelen, meer te weten komen over het onbenutte potentieel ervan
- Wat is de rol van Dessicant in Dessicator?
- Onderzoekers boeken belangrijke vooruitgang bij het printen van circuits op draagbare stoffen

- Moedermelk als hulpmiddel voor medicijnafgifte

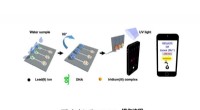
- Nieuw apparaat voor snelle en nauwkeurige detectie van lood
- Het pad verlichten naar het recyclen van koolstofdioxide
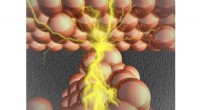
- De kloof op nanoschaal overbruggen:een diepe blik in atomaire schakelaars
 Wat zijn de toeristische activiteiten voor een loofbos?
Wat zijn de toeristische activiteiten voor een loofbos?  Wat is verder weg van de aardsterren of de zon?
Wat is verder weg van de aardsterren of de zon?  Skat en poker:meer geluk dan vaardigheid?
Skat en poker:meer geluk dan vaardigheid? In de evolutiekloof tussen quasars en normale spiralen liggen?
In de evolutiekloof tussen quasars en normale spiralen liggen?  Leg uit hoe wetenschappers fossielen gebruiken om de evolutietheorie te ondersteunen?
Leg uit hoe wetenschappers fossielen gebruiken om de evolutietheorie te ondersteunen?  Facebook-opruiming:de aandelen schaden, de wereld helpen?
Facebook-opruiming:de aandelen schaden, de wereld helpen? Hoe beïnvloedt CO2 de opening van de huidmondjes?
Hoe beïnvloedt CO2 de opening van de huidmondjes?  Time Earth neemt de zon inot om de zon te draaien?
Time Earth neemt de zon inot om de zon te draaien?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

