
Wetenschap
Hoe zijn de elektronen rond nucleus gerangschikt en hoe zij de reactiviteit beïnvloeden?
Elektronenopstelling en reactiviteit
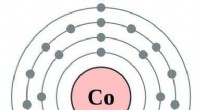
Elektronen zijn gerangschikt rond de kern van een atoom in specifieke energieniveaus, genaamd elektronenschalen . Elke schaal kan een maximaal aantal elektronen bevatten:
* shell 1 (k shell): Bevat maximaal 2 elektronen
* shell 2 (l shell): Bevat maximaal 8 elektronen
* shell 3 (m shell): Bevat maximaal 18 elektronen
* shell 4 (n shell): Bevat maximaal 32 elektronen
Binnen elke schaal worden elektronen verder georganiseerd in subshells (S, P, D, F) met verschillende vormen en energieën. De buitenste schaal wordt de valentie -schaal genoemd , en de elektronen worden valentie -elektronen genoemd .
reactiviteit wordt voornamelijk bepaald door het aantal valentie -elektronen en hun opstelling:
* atomen met een volledige valentie -schaal (8 elektronen) zijn over het algemeen niet -reactief of inert. Ze hebben een stabiele configuratie en zijn inhoud met hun elektronenopstelling. De edelgassen (HE, NE, AR, KR, XE, RN) zijn bijvoorbeeld inert vanwege hun volledige valentieschalen.
* atomen met minder dan 8 valentie -elektronen zijn over het algemeen reactief. Ze hebben de neiging om elektronen te winnen, te verliezen of te delen om een stabiele configuratie te bereiken met een volledige valentie -shell.
* Het aantal valentie -elektronen bepaalt het type chemische bindingen dat een atoom kan vormen. Atomen met 1-3 valentie-elektronen hebben de neiging elektronen te verliezen en positieve ionen te vormen (kationen). Atomen met 5-7 valentie-elektronen hebben de neiging elektronen te krijgen en negatieve ionen (anionen) te vormen. Atomen met 4 valentie -elektronen kunnen elektronen verliezen of opdoen, of elektronen delen om een stabiele configuratie te bereiken.
Voorbeeld:
* natrium (na) heeft 1 valentie -elektron. Het verliest gemakkelijk dit elektron om een stabiele configuratie zoals Neon (NE) te bereiken, die een volledige valentie -schaal heeft. Dit maakt natrium zeer reactief en vormt een kation (Na+).
* chloor (Cl) heeft 7 valentie -elektronen. Het krijgt gemakkelijk 1 elektron om een stabiele configuratie zoals Argon (AR) te bereiken, met een volledige valentie -schaal. Dit maakt chloor zeer reactief en vormt een anion (Cl-).
Verdere factoren die de reactiviteit beïnvloeden:
* elektronegativiteit: De neiging van een atoom om elektronen naar zichzelf aan te trekken. Meer elektronegatieve atomen hebben meer kans om elektronen te krijgen en negatieve ionen te vormen, waardoor ze reactiever worden.
* ionisatie -energie: De energie die nodig is om een elektron uit een atoom te verwijderen. Atomen met lage ionisatie -energie hebben meer kans om elektronen te verliezen en positieve ionen te vormen, waardoor ze reactiever worden.
* Atomaire maat: Kleinere atomen zijn meestal reactiever vanwege hun meer geconcentreerde elektronenwolken, die gemakkelijker kunnen interageren met andere atomen.
Inzicht in de rangschikking van elektronen rond de kern is cruciaal voor het voorspellen en verklaren van de reactiviteit van elementen. Deze kennis helpt ons om te begrijpen hoe atomen combineren om moleculen te vormen en hoe chemische reacties optreden.
 Hoe Enthalpy of Air te berekenen
Hoe Enthalpy of Air te berekenen  Wat is de dichtheid van waterstofgas?
Wat is de dichtheid van waterstofgas?  Welke deeltjes zijn kleiner - waterstof of koolstofdioxide?
Welke deeltjes zijn kleiner - waterstof of koolstofdioxide?  Zelfassemblage in meerdere stappen opent de deur naar nieuwe herconfigureerbare materialen
Zelfassemblage in meerdere stappen opent de deur naar nieuwe herconfigureerbare materialen Onderzoekers tonen aan dat organische kristallen kunnen dienen als energieomzetters voor opkomende technologieën
Onderzoekers tonen aan dat organische kristallen kunnen dienen als energieomzetters voor opkomende technologieën
 Internationale analyse verkleint de gevoeligheid van het klimaat voor koolstofdioxide
Internationale analyse verkleint de gevoeligheid van het klimaat voor koolstofdioxide Nieuwe drainagebehandeling voor zuurmijnen verandert afval in waardevolle essentiële mineralen
Nieuwe drainagebehandeling voor zuurmijnen verandert afval in waardevolle essentiële mineralen Wanneer denk je dat een levenswetenschapper niet -levend zou bestuderen, zoals meer of rock?
Wanneer denk je dat een levenswetenschapper niet -levend zou bestuderen, zoals meer of rock?  Onderzoek toont een fundamenteel verschil aan tussen de manier waarop insecten en zoogdieren geuren detecteren
Onderzoek toont een fundamenteel verschil aan tussen de manier waarop insecten en zoogdieren geuren detecteren  FEITEN CONTROLEREN:Wetenschap is in tegenspraak met EPA opwarmingsmemo
FEITEN CONTROLEREN:Wetenschap is in tegenspraak met EPA opwarmingsmemo
Hoofdlijnen
- Hoe ERF1 de bloei reguleert
- Eerste Amerikaanse vrouw bevalt van getransplanteerde baarmoeder
- Hoe alleen genetica bepalen wie je bent?
- Wat zijn het mannelijke en vrouwelijke deel van een plant?
- Uitleg van celspecialisatie
- Nauwkeurig bijhouden hoe plastic biologisch afbreekt
- Waarom ben je in de wetenschap?
- Hoe weefselgeometrie de beweging van cellen door het lichaam beïnvloedt
- Ver van harpoenen, walvissen schitteren in de boom van ecotoerisme in IJsland
- Techniek kan helpen bij massaproductie van biologisch afbreekbaar plastic

- Moderne alchemisten maken scheikunde groener
- Wetenschappers ontwikkelen nieuwe technologie voor de winning van non-ferro en edelmetalen

- Een eenvoudig en universeel ontwerp voor brandstofcelelektrolyt
- 3D-geprinte kunstmatige hoornvliezen vergelijkbaar met menselijke hoornvliezen
 Ultrasnel op laser gebaseerd schrijven van gegevens naar opslagapparaten
Ultrasnel op laser gebaseerd schrijven van gegevens naar opslagapparaten Stikstof en waterstof reageren om ammoniak te vormen. Als je 45 gram stikstof met 30 waterstof combineert, wat zal de massa dan uiteindelijk zijn?
Stikstof en waterstof reageren om ammoniak te vormen. Als je 45 gram stikstof met 30 waterstof combineert, wat zal de massa dan uiteindelijk zijn?  Waarom wordt goud gemengd met zilver of koper?
Waarom wordt goud gemengd met zilver of koper?  Wat is de massa van een object met een gewicht 45,32 n?
Wat is de massa van een object met een gewicht 45,32 n?  Nieuw materiaal om de grenzen van op silicium gebaseerde elektronica te verleggen
Nieuw materiaal om de grenzen van op silicium gebaseerde elektronica te verleggen Is het tijd om gerichte advertenties en de webreuzen die hiervan profiteren te reguleren?
Is het tijd om gerichte advertenties en de webreuzen die hiervan profiteren te reguleren? Wie heeft de elektronenpooltheorie uitgevonden?
Wie heeft de elektronenpooltheorie uitgevonden?  Wat kan een individu doen om het milieu te beschermen?
Wat kan een individu doen om het milieu te beschermen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

